 Geschwister.
Geschwister.
Foto: Sathyatripodi, Pixabay
So haben bereits vor rund 20 Jahren Wissenschaftler und Wissenschaftlerinnen versucht, neue tierleidfreie Lösungen für die Reproduktionstoxikologie zu finden. Ein derartiger Vorstoß wurde z.B. zwischen 2004 bis 2009 mit dem EU-Projekt ReProTect unternommen. Dabei wurden 14 Methoden zum Test auf Reproduktions- und Entwicklungstoxikologie entwickelt und in einer Testbatterie geprüft.
Inzwischen haben sich technologischer Fortschritt und wissenschaftliche Erkenntnisse weiterentwickelt. Reproduktionsorgane können auf Multiorganchips im Miniaturformat gezüchtet werden, die sogar in der Lage sind, den Hormonzyklus zu simulieren. Induzierte pluripotente Stammzellen bieten zukünftig das Potenzial, das gewünschte Humangewebe nachzuzüchten und ggfs. aus 3D-Druckern kommend „in Form“ zu bringen. Die Gentechnik erlaubt, in Zellen Reportergene einzubauen, die z.B. mit einem Fluoreszenzsignal einen schädigenden oder störenden Effekt schnell und auf Wunsch im Hochdurchsatz feststellen lassen. Wir stellen hier nur einige Highlights vor.
Ersatz von Tierversuchen der in Reproduktionstoxikologie: Kleine Schritte
Zwischen 2004 bis 2009 lief das EU-Projekt ReProTect mit dem Ziel, neue Ansätze in der Reproduktionstoxizität durch Kombination von in-vitro-Methoden und Gewebe- und Sensortechnologien zu finden (1, 2). Beteiligt waren 32 europäische Forschergruppen aus Akademie, Industrie, kleiner und mittlerer Unternehmen und Regierungsinstitutionen. Eine Reihe von alternativen Testsystemen wurden entwickelt, die die verschiedenen Stadien des Fortpflanzungszyklus abdecken sollten. In einer Ring-Machbarkeitsstudie mit einer festgelegten Anzahl von Testchemikalien wurden die Methoden von einer externen, unabhängigen Expertengruppe beurteilt.
Im Rahmen dieses EU-Projekts wurden sechs Rezeptorbindungstests zur Untersuchung von hormonwirksamen Substanzen entwickelt, von denen der sogenannte AR CALUX® am Ende in die OECD-Testrichtlinien eingeflossen ist. Er ist ein Reportergen-Assay, mit dem die androgene und anti-androgene Aktivität von Verbindungen in vitro geprüft werden kann. Androgen wirkende Substanzen binden an den sogenannten Androgen-Rezeptor und lösen einen für die androgene Wirkung charakteristischen Effekt aus. Anti-Androgene blockieren dagegen den Androgen-Rezeptor und verhindern so die Androgenwirkung.
Ein ähnlicher Assay wurde mit einer humanen Osteosarkom-Zelllinie (U2-OS) unter Einbau eines humanen Östrogenrezeptors konstruiert (3), um das östrogene und anti-östrogene Potenzial von Chemikalien zu messen. Der Assay wurde 2015 von der OECD validiert und für eine Aufnahme in die OECD "Performance Based Test Guideline for Stably Transfected Transactivation In vitro Assays to Detect Estrogen Receptor Agonists and Antagonists" (TG 455), als Bestandteil einer abgestuften Teststrategie als geeignet befunden (4). Dort ist er im Anhang 4 auch enthalten. Andere Rezeptorbindungsassays waren der MELN-Assay mit einer Brustkrebszelllinie (MCF-7), in die ein auf Östrogen ansprechendes Gen eingebaut wurde (5), und der MTS-Assay mit einer humanen Prostata-Adenokarzinom-Zelllinie (LNCaP), um Moleküle zu identifizieren, die auf die Prostatafunktion abzielen (6).
Fünf weitere Tests gaben Auskunft über Fruchtbarkeitsstörungen (Follikulogenese und Oogenese): Ein in-vitro-Fertilisationstest über die Störung der Befruchtungsfähigkeit und ein peri-Implantationstest mit einer Zygote der Maus, deren Entwicklung bis zum Stadium der Blastozyste verfolgt wurde. Der Ishikawa-Zelltest ermöglichte Aussagen zu Implantation und östrogener Aktivität (7). Ein modifizierter Comet-Assay (ReProComet) diente zum Nachweis von DNA-Strangbrüchen in Rinderspermien. Da die Substanzbindung an die DNA von Spermien normalerweise erst nach der Befruchtung auftritt und in Spermien selbst nicht detektiert werden kann, da diese kein Reparaturenzymsystem haben, wurde für den Test ein Extrakt von humanen Brustkrebszellen (HeLa) zu den in Agarose eingebetteten Rinderspermien gegeben (8, 9).
Um die Plazentadurchgängigkeit von Bisphenol A, eine Östrogen-ähnliche Substanz (10), zu untersuchen, haben Wissenschaftler eine Trophoblasten-Zelllinie (Trophoblast ist die ernährende Hüllzellschicht des Embryos) und humane Plazenta-Explantatkulturen kombiniert und damit Plazenta-Perfusionstests durchgeführt. Das kombinierte Gewebe war in der Lage, das wichtige Schwangerschaftshormon hCG zu bilden. Durch die hormonwirksamen Testchemikalien stieg in den Plazenta-Explanaten die Hormonmenge an hCG und die Expression von Caspase 3, ein Apoptoseprotein. Die Trophoblasten-Zellen wurden geschädigt (11). Zum Test auf Plazenta-durchgängigkeit von Stoffen konstruierten Forscher ein Plazenta-Perfusionsmodell mit zwei unabhängigen Kreisläufen, die dem Blutkreislauf der Mutter und dem des Fötus entsprechen (12, 13, 14).
Bei Tests auf embryonale Entwicklung waren drei Modelle favorisiert bzw. entwickelt worden: Zum einen der Whole Embryo Culture (WEC) Test mit Rattenembryonen, der Wachstums- und Entwicklungsschäden des Embryos untersucht und sich bei der Chemikalientestung durchgesetzt hat. Ein weiterer ist der murine embryonale Stammzelltest (mEST), mit dem die untersuchte die Differenzierungshemmung von embryonalen Stammzellen der Maus in Herzzellen untersucht wird. Der dritte Test, der ReProGlo Assay, befasste sich mit der Hemmung des sogenannten Wnt-Signalweges (genauer: kanonischen Wnt/-Catenin-Signalweg) durch Medikamente. Wnt ist einer von sechs bedeutenden Signalwegen und während der Regulation der frühen Embryogenese aktiv. Eine Störung dieses Weges führt zu abnormen Entwicklungen des Embryos. Der Test erforderte bei manchen chemischen Testsubstanzen die vorherige metabolische Aktivierung durch Leberzellen (15, 16). Kritiker bemängelten jedoch eine geringe Vorhersagegenauigkeit dieses Tests (17).
Forscher testeten alle Entwicklungen in Form einer umfangreichen Testbatterie mit zehn Teststoffen und beurteilten die entwickelten Methoden zum Ersatz von Tierversuchen als „vorsichtig positiv“. Sie konnten die toxikologisch relevanten Eigenschaften der Teststoffe mit relativ hoher Genauigkeit in der Mehrheit der Fälle erkennen. Lediglich ein zuverlässiger spezifischer Test für die männliche Fertilität fehlte (18). Am Ende wurden jedoch nur wenige Entwicklungen in die Testrichtlinien aufgenommen.
![]()
Fruchtbarkeitsstatue.
Foto: Domaris, Pixelio.de
In ReProTect kombinierten Wissenschaftler auch vier bereits verfügbare Softwaretools (CAESAR (Q)SAR-Modell, das Derek für Windows-Expertensystem, den estrogen-receptor-binding profiler der OECD/(Q)SAR Application Toolbox und ein Read-across-Modell) in einem sogenannten Weight-of-Evidence-Ansatz miteinander, um die Reproduktions- und Entwicklungstoxizität rechnerisch vorauszusagen. Aufgrund der Komplexität der Reproduktions- und Entwicklungstoxizität waren die Ergebnisse jedoch nicht ausreichend (19).
Aktuelle Entwicklungen
Viele Wissenschaftler und Wissenschaftlerinnen sind überzeugt, dass z.B. neue Chipsysteme mit humanem Gewebe oder nachgebildeten Organen im Bereich der Reproduktionstoxizität Aufklärung bringen und neue Therapieansätze ermöglichen können. In den letzten Jahren ist die Entwicklung hier rasant vorangeschritten. An dieser Stelle können nur einige Verfahren vorstellt werden.
In-vitro-Eileitermodell
Einer Forschergruppe unter der Leitung von Dr. Jennifer Schön vom Leibniz-Institut für Nutztierbiologie in Dummerstorf ist es gelungen, ein 3D-Zellkultur-Modell des Eileiters zu etablieren. Allerdings stammen die Eileiter hier von Rindern und Schweinen. In der „Eileiterflüssigkeit“ des Modells konnten sich sogar Embryonen entwickeln, so dass mit dem Modell frühe Interaktionen zwischen Embryo und Muttertier untersucht werden können, denn frühembryonale Verluste sind eine der häufigsten reproduktiven Störungen beim Menschen und beim Tier (20).
In-vitro-Modell des Follikelwachstums
Einem amerikanischen Forscherteam unter der Leitung von Prof. Theresa Woodruff vom Women’s Health Research Institute at Northwestern University Feinberg School of Medicine in Evanston, Illinois, ist es gelungen, primäre menschliche Follikel - die Vorstufe der weiblichen Eizelle - zu isolieren, zu kultivieren und sich weiterentwickeln zu lassen. Frühstadien der Follikelentwicklung in vitro erforderten deren Einkapselung in Alginat sowie die Unterstützung durch natürliches Eierstock-Kortexgewebe (21).
Männliche Keimdrüsen in vitro
Ein Dänisch-Schottisches Forscherteam unter der Leitung von Prof. Anders Juul und Dr. Ewa Rajpert-De Meyts vom Rigshospitalet der Universität Kopenhagen hat humane männliche fötale Keimdrüsen aus Gewebe von Föten aus Schwangerschaftsunterbrechungen isoliert und in einer sogenannten hanging drop-Kultur kultiviert. In dem Modell getestet wurde Retinsäure, welche starke Fehlbildungen auslösen kann und daher einen Einfluss auf die Embryonalentwicklung hat. Überschüssige Retinsäure zum Zeitpunkt der Hodenentwicklung führt zu einer Störung der Keimzellentwicklung (22). Leider stammten die Zellen von humanen Embryonen und stellen aus ethischen Gründen in der Form keine wirkliche Perspektive dar.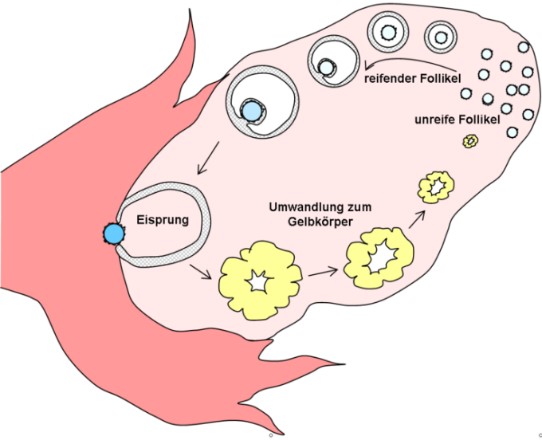
Zyklus der Eizellreifung im Eierstock.
Grafik. H. Hoffmeister, Wikipedia.
Organ-on-a-Chip-Entwicklungen
Herkömmliche, von menschlichen Zellen abgeleitete Modelle betrachten die toxikologischen Vorgänge isoliert und entfernt von einer normalen physiologischen Mikroumgebung. Daher versuchen Wissenschaftler und Wissenschaftlerinnen die Mikrophysiologie mittels Organ-on-a-chip oder Human-on-a-chip-Modellen nachzubilden. Menschliches Gewebe wird in ein sogenanntes mikrofluidisches System integriert, das die Komplexität der menschlichen in-vivo-Physiologie in vitro nachahmen soll. Die Simulation des weiblichen und männlichen Fortpflanzungssystems mit jeweils mehreren Organen und dem komplexen Hormonsystem ist zurzeit jedoch noch eine besondere Herausforderung.
3D-Modell der menschlichen Plazenta
Wiener Wissenschaftler um Prof. Aleksandr Ovsianikov vom Institut für Werkstoffwissenschaften und Werkstofftechnologie haben ein künstliches Plazenta-Modell entwickelt. Für das Modell wurden eine humane Trophoblasten-Zelllinie (BeWo b30) und humane primäre Plazenta-Zotten-Endothelzellen verwendet. Mit einem lasergesteuerten 3D-Druck-Verfahren lassen sich aus Hydrogelen hochpräzise Formen herstellen, die dann mit Plazenta-Zellen besiedelt werden. Das so erzeugte Organoid wächst auf einem mikrofluidischen Chip, an dem wichtige biologische Parameter wie Druck, Temperatur oder Nährstoff-bzw. Arzneistoffversorgung eingestellt werden können. Mit dem Modell lässt sich eine Plazenta-Barriere mit Durchlässigkeit für große Proteine ähnlich dem natürlichen Gewebe bilden. Zwei getrennte Kammern simulieren die Flüssigkeitsströmungen in dem fetalen und mütterlichen „Organismus“. Die Zellen sind in der Lage, bestimmte Strukturproteine (E-Cadherin) und Proteintransporter auszubilden (23).
Auch Forscher von den Swiss Federal Laboratories für Materials Science and Technology (EMPA) unter der Leitung von Dr. Tina Buerki-Thurnherr haben ein Plazentaorganoid-Modell auf dem Chip entwickelt. Sie untersuchen, ob Nanopartikel die Plazentaschranke überwinden können (24).
Chinesische Forscher unter der Leitung von Prof. Jianhua Qin vom Dalian Institute of Chemical Physics (DICP) der chinesischen Academy of Sciences in Beijing haben dagegen ein Krankheitsmodell entwickelt: Einer in vitro konstruierten Plazentaschranke gaben sie Bakterien hinzu, um Entzündungs-prozesse zu untersuchen, die in der Schwangerschaft zu Fehlentwicklungen beim Fötus oder einer Fehlgeburt führen können (25).
Mit einer ähnlichen Forschung befassen sich Prof. Katharina Ribbeck vom Massachusetts Institute of Technology (MIT) in Boston und ihr Team. Sie haben ein Muttermundschleimhaut-Modell auf dem Chip entwickelt (26). Damit wird der Bakterientransport durch die Schleimhaut untersucht. Der Aufstieg von Bakterien in der Gebärmutter während der Schwangerschaft kann zu einer Frühgeburt führen.
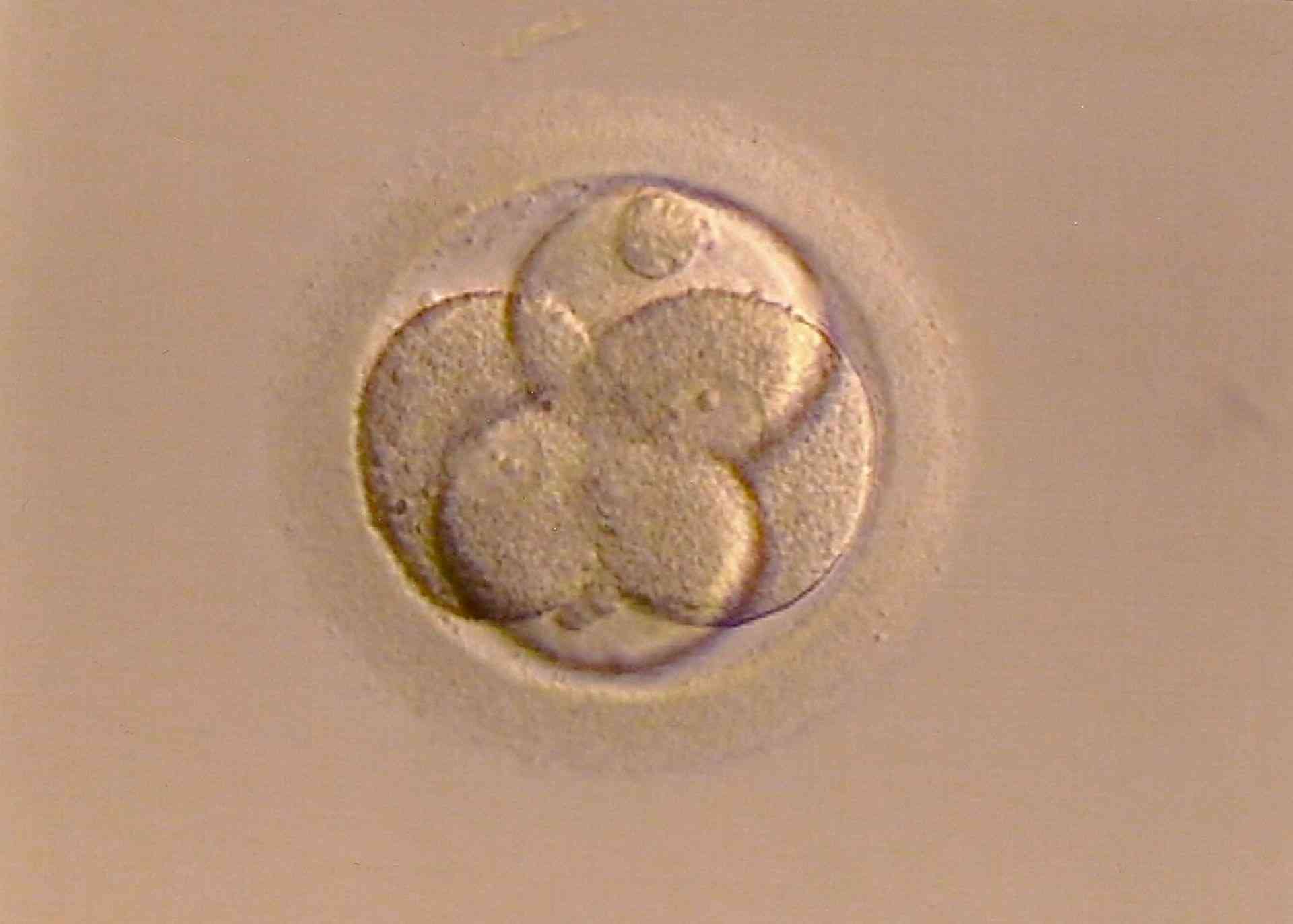
Zygotenentwicklung (8-Zellstadium).
Foto: Bellezza87, Pixabay.
Simulation des humanen weiblichen Menstruationszyklus („Repro-on-a-Chip“)
Unter der Leitung von Prof. Theresa Woodruff, Leiterin des Women’s Health Research Institute at Northwestern University Feinberg School of Medicine in Evanston, Illinois, gelang es einem Forscherteam, das Hormonprofil des menschlichen 28-tägigen Menstruationszyklus der Frau nachzubilden. Dafür wurden mehrere mikrofluidische Systeme und Ovarialfollikel der Maus verwendet. Gesundes Eierstockgewebe von Probandinnen stand nicht zur Verfügung und kann aus ethischen Gründen auch nicht gewonnen werden. Ein-, zwei- und mehrstufige mikrofluidische Plattformen wie der EVATAR (27) bildeten einen Kreislauf zwischen den kultivierten Geweben des weiblichen Fortpflanzungstrakts (Eierstock-, Eileiter-, Muttermund- und Lebergewebe sowie Gebärmutterschleimhautzellen) und versorgten die Organ-ähnlichen Systeme mit Hilfe von Mikropumpen mit den entsprechend benötigten Hormonen wie Follikel-stimulierendem Hormon (FSH), luteinisierendem Hormon (LH) und humanem Choriongonadotropin (hCG) in einem zeitlich abgestimmten Regime. Es konnten Follikelwachstum, Follikelreifung und ein Einsprung simuliert werden. Das Gewebe bildete während des Follikelreifungsprozesses die Hormone Progesteron und 17b-Östradiol. Mit Ausnahme der Ovarien und der Follikel stammte sämtliches Gewebe aus Humanbiopsien. Es konnte über einen Zeitraum von 28 Tagen kultiviert werden (28). Derzeit arbeitet das Team daran, die verschiedenen Organkulturen auf einer Plattform zu kultivieren und damit einen vollständigen weiblichen Reproduktionstrakt auf einer mikrofluidischen Plattform zu etablieren. Die Eierstockfollikelhormone werden dann über die Zellkulturmedien in den Eileiter, die Gebärmutter und die innere und äußere Schicht des Muttermunds (Endozervix und die Ektozervix) fließen. Das System wird derzeit validiert, u.a. wird die Verwendung alternativer Zellquellen wie z.B. induzierte pluripotente Stammzellen angestrebt (29).
Es ist beeindruckend und wegweisend, dass es dem amerikanischen Wissenschaftlerteam gelungen ist, die Hormonregulation auf dem Chip zu simulieren. Damit können nicht nur hormonelle Effekte auf die Reproduktion, sondern auch auf andere organähnliche Systeme auf dem Chip wie z.B. das Herz untersucht werden (30). Derzeit entwickelt das Team den DudeKUBE, ein in-vitro-Modell, das die männlichen Keimdrüsen auf dem Chip nachbildet (31). Ziel ist es, entsprechend dem weiblichen Pendant EVATAR den männlichen Reproduktionstrakt (DudeKUBE) auf dem Chip nachzubilden (32).
Tierversuchsfreie Verfahren in der Entwicklungsneurotoxizität (DNT)
Während der Schwangerschaft kann es zu einer Störung der Nervenzellentwicklung des Fötus kommen, was zu veränderten Nervenzellverbindungen führen kann. Umweltgifte können Teilung, Differenzierung oder Migration von Nervenzellen hemmen (33). Diese Störungen zeigen sich später häufig in Lernschwächen, Entwicklungsverzögerungen, Störungen aus dem Autismus-Spektrum sowie Aufmerksamkeitsdefizit- und Hyperaktivitätsstörungen. Bezüglich der Ursachen werden sowohl Umweltchemikalien als auch Arzneimittel diskutiert. Nach Schätzungen sollen allein ca. 4% der verschreibungspflichtigen Medikamente wegen beobachteter unerwünschter neurologischer Wirkungen vom Markt genommen worden sein (34).
Diese Störungen werden mit Entwicklungsneurotoxizitätstests (DNT-Tests) an der Ratte untersucht. Diese Tests wurden bislang standardmäßig von den Regulationsbehörden nicht gefordert. Gemäß der europäischem Chemikalienrichtlinie REACH werden sie jedoch zusätzlich durchgeführt, wenn es in der erweiterten Ein-Generationen-Studie an der Ratte zuvor Hinweise auf DNT gegeben hat. Das ist der Fall, wenn Störungen bei der Cholinesterase (Leberschäden) oder Veränderungen bei den Schilddrüsenhormonen oder im Östrogenhaushalt gefunden wurden.
Wissenschaftler wie Prof. Marcel Leist, der selbst an DNT forscht, kritisieren jedoch, dass die meisten DNT-Endpunkte am Tier gar nicht gemessen werden können, so z.B. Sprachstörungen, eine Beeinträchtigung der Aufmerksamkeitsdauer oder der IQ (35). In Studien wurden bedeutende Artunterschiede bei der DNT zwischen Nagetier und Mensch mit in-vitro-Testsystemen gefunden (36). Ein Forscherteam unter der Leitung von Prof. Ellen Fritsche vom Institut für umweltmedizinische Forschung In Düsseldorf untersuchte mit Hilfe sogenannter Neurosphären aus induzierten pluripotenten Stammzellen (hiPSCs) des Menschen, der Maus und der Ratte den Einfluss von Umweltchemikalien auf die Frühentwicklung des Gehirns. Getestet wurden Zellproliferation, Zelldifferenzierung, Zellmigration und Apoptose - alles Vorgänge, die sich im entwickelnden Gehirn abspielen (37).
Ein möglicherweise geeigneter Test ist der NeuriTox-Test aus der Arbeitsgruppe von Prof. Marcel Leist, Leiter des Doerenkamp-Zbinden-Lehrstuhls an der Universität Konstanz. Er basiert auf einer Zelllinie von humanen immortalisierten neuronalen Zellen des Mittelhirns, den sogenannten LUHMES-Zellen. Um die Eignung für Tests zu beurteilen, wurde bereits eine Vielzahl an Substanzen gescreent (38). In einem Subtyp dieser Zelllinie hat Dr. Stefan Schildknecht von der Universität Konstanz ein Fluoreszenzgen in die Mitochondrien der Zellen eingebracht, um die Bewegung von Mitochondrien zur Einschätzung einer Degeneration von Nervenzellen durch Testsubstanzen verfolgen zu können (39). Der Test ist soweit weiterentwickelt worden, dass er im Hochdurchsatzverfahren eingesetzt werden kann (40).
Regulationsbehörden wie z.B. die EFSA arbeiten mit Wissenschaftlern und Wissenschaftlerinnen zusammen an einer kosteneffizienten Teststrategie auf Basis einer zuverlässigen in-vitro-Testbatterie, um DNT-Gefahren ermitteln und Maßnahmen zur Verringerung der Exposition gegenüber diesen Chemikalien einleiten zu können (37). Dabei wollen sie die sogenannte Adverse Outcome Pathway-(AOP) Konzeption nutzen. AOPs beschreiben Vorgänge, die von einem auslösenden molekularen Ereignis an der Zelloberfläche ausgehen, und über einen chemischen Stressfaktor und eine Kaskade biologischer Reaktionen durch verschiedene biologische Ebenen aufwärts (Organell, Zelle, Gewebe, Organ, Gesamtorganismus) im Laufe der Zeit zu einem schädigenden Effekt führt. Ist einer dieser AOPs nachweislich betroffen, ließe das Rückschlüsse auf die DNT-Eigenschaften der Substanz zu.
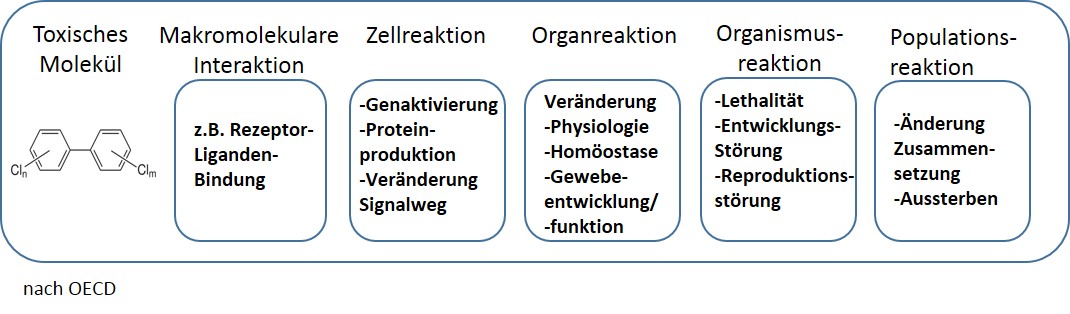
Tierversuche und tierversuchsfreie Verfahren in der Chemikaliengesetzgebung
Chemikalien ab einer Produktionsmenge von 10 Tonnen und mehr pro Jahr (REACH-Verordnung Anhang VIII und IX), Pestizide, Lebensmittelzusatzstoffe, Medikamente und andere Substanzen müssen auf ihr Potenzial zur Verursachung von Reproduktions- oder Entwicklungsschäden getestet werden.
Reproduktionstoxizitätstests bewerten die Tendenz eines Stoffes, Schäden am Fortpflanzungssystem zu verursachen. Eine Substanz ist dann reproduktionstoxisch (=fortpflanzungsgefährdend), wenn sie eine Beeinträchtigung der männlichen oder weiblichen Fruchtbarkeit zur Folge hat, frucht- oder entwicklungsschädigend wirkt oder nicht vererbbare Schäden bei den Nachkommen auslöst (41).
Entwicklungstoxizitätstests untersuchen dagegen das Ausmaß, in dem eine Exposition für einen sich entwickelnden Embryo oder Fötus im Mutterleib schädlich sein kann. Allgemein können schädigende Effekte in jedem Stadium der Entwicklung auftreten, was zum Tode, zu Deformation, veränderndem Wachstum oder zu funktionellen Defiziten führen kann.
Reproduktions- und Entwicklungstoxizitätstests sind in der Regel mit der Verwendung einer großen Anzahl von Tieren verbunden. Aufgrund der europäischen Einigung zur Reduktion von Tierversuchen haben Wissenschaftler und Regulationsbehörden versucht, durch neue Richtlinien den Verbrauch von Versuchstieren zu senken, z.B. anstelle der zwei-Generationen-Reproduktionsstudie eine erweiterte Ein-Generationen-Studie zuzulassen. Bei der Anerkennung von Ersatzverfahren zum Tierversuch sieht es bescheiden aus: Lediglich der in-vitro-Östrogen- und -Androgenrezeptor-Tests befinden sich in der Bibliothek der Testrichtlinien (TG 455, 458 und 493).
Pränatale Entwicklungstoxizitäts-Studie (TG 414)
Bei der pränatalen Entwicklungstoxizitätsstudie sollen allgemeine Informationen über die Effekte der pränatalen Exposition über schwangere Versuchstiere und den sich entwickelnden kindlichen Organismus (Tod, Struktur-Anomalitäten oder Wachstumsveränderungen des Fötus) erzielt werden. Funktionelle Mängel als wichtiger Teil der Entwicklung werden mit dieser Richtlinie nicht behandelt. Testspezies sind die Ratte und – als Nicht-Nagetier – das Kaninchen. Hier werden pro Substanz und Testspezies wenigstens 260 Tiere verbraucht (42).
Erweiterte Ein-Generationen-Studie (TG 443)
Für die erweiterte Ein-Generationen-Studie erfolgen Untersuchungen zu Lebensfähigkeit, Gesundheitszustand der Neugeborenen, Entwicklungsstadium bei Geburt, physische und funktionale Entwicklung bis zum Erwachsenenstadium, Funktion der Gonaden, Östruszyklus, Spermienreifung in den Nebenhoden, Verhalten bei Reife, Empfängnis, Schwangerschaft, Geburtsvorgang und Milchbildung, nachdem den Tieren die Testsubstanz über das Trinkwasser, eine Schlundsonde, inhalativ oder dermal verabreicht worden war, je nach Substanzeigenschaft (43). Er werden pro Substanz und Testspezies wenigstens 680 bis 1.000 Tiere verbraucht. (Zum Vergleich: in der Zwei-Generationen-Studie sind es rund 3.200 (44).
Die Fortpflanzung: ein kompliziertes Zusammenspiel zwischen Organen und Hormonen
Die Fruchtbarkeit ist die Fähigkeit, ein Kind zu zeugen oder zu empfangen. Es werden dafür u.a. befruchtungsfähige, aktiv bewegliche Spermien, ein günstiges Empfangsmilieu und eine zyklische Hormonproduktion gebraucht. Störungen können anatomischer oder hormoneller Art oder durch das Immunsystem bedingt sein. Ein Verlust von Steroidsignalen in produzierenden Geweben führt beispielsweise zu schlechter Samenqualität und beeinträchtigt die Fruchtbarkeit. Ein gestörtes Zusammenspiel der Hormone im Monatszyklus der Frau kann die Fruchtbarkeit ebenfalls beeinträchtigen. Eine Schilddrüsenüber- oder Unterfunktion reicht beispielsweise aus, um den Eisprung zu verhindern, ein Übermaß an Androgenen kann die Eizellreifung verhindern (45, 46). Die Gliedmaßen des Embryos sind zwischen dem 29. und 46. Tag für Störungen und folgende Fehlentwicklungen besonders anfällig. In der gesamten Entwicklungszeit des Embryos bzw. Fötus kann eine Vielzahl an Störungen auftreten, die z.B. zu verkleinerten Organen, fehlenden oder deformierten Gliedmaßen und anderen Fehlbildungen führen können.
Diese Fehlbildungen können sowohl durch Krankheitserreger (Zika-Virus) (47) als auch durch Medikamente (Bsp. Thalidomid) oder Chemikalien verursacht werden (48). Substanzen, die Fehlbildungen auslösen können, nennt man teratogene. Im Nachhinein können auch Krebs oder auch endokrine Störungen bis hin zu Verhaltensauffälligkeiten auftreten. Es wird allgemein angenommen, dass z.B. Umweltchemikalien auch für Verhaltensauffällig-keiten wie das Aufmerksamkeitsdefizit-Syndrom (ADHS) verantwortlich sein könnten (49).Eine zentrale Rolle spielt die Plazenta, über die die Nährstoffe und Antikörper von der Mutter übertragen werden. Es gibt zwar eine Schranke zwischen mütterlichem und kindlichem Blutkreislauf (Plazenta-Schranke), dennoch können einige Substanzen, wie Viren, Alkohol, Medikamente und Hormone hindurch gelangen (50).
|
Arzneimittelentwicklung
Auskunft über durchzuführende Tierversuche geben zwei Richtlinien, die ICH Richtlinien S5(R2) und S5(R3). Die S5(R3) untersucht in mehreren Schritten die weibliche und männliche Fortpflanzungsfunktion über drei Generationen. Studien sollen gemäß Vorschrift an Säugetierarten (vor allem Ratte) durchgeführt werden. Nur In Embryotoxizitätsuntersuchungen ist eine zweite Säugetierart vorgesehen (Kaninchen). Der Grund ist ein anderer Stoffwechsel von Nagern: So konnte beispielsweise die Organschädlichkeit von Contergan bei sich entwickelnden Nachkommen in der Nager-Spezies Ratte nicht entdeckt werden. Aber auch bei den Kaninchen gibt es Einschränkungen: Von ihnen fehlen oft kinetische und toxische Daten, sie sind anfällig für einige Antibiotika und für Störungen des Verdauungstraktes. Außerdem können klinische Anzeichen schwer zu interpretieren sein. (51). Für die Impfstoffentwicklung werden zudem Kaninchen eingesetzt. Bei der Produktion vieler monoklonaler Antikörper sind nicht-humane Primaten (NHPs) die einzig pharmakologisch relevante Spezies (vgl. ICH S6(R1) (52). NHPs finden nur dann Verwendung, wenn keine andere relevante Tierart verfügbar ist. Wissenschaftler versuchen jedoch, NHPs durch gentechnisch veränderte Mäuse zu ersetzen (52).
Regulationsmühlen mahlen langsam
Im Oktober 2017 gab es einen Workshop der European Medical Agency zu "non-animal approaches" mit dem Ziel einer Revision der ICH Richtlinie S5(R3). Die European Medicines Agency (EMA) als Regulationsbehörde scheint demnach verhalten aufgeschlossen gegenüber "alternativen Assays" zu sein (53), die Bestandteil einer integrierten Teststrategie werden sollen. Unter "alternativen Assays" werden hier allerdings nicht nur in-vitro-, sondern auch ex-vivo- und nicht-Säugetier-in-vivo-Assays verstanden, wie Zellsysteme, Gewebe, Organe oder Organismen (z.B. Whole Embryo Culture mit Ratten- Kaninchen- und Zebrafisch-Embryonen). Einige dieser Assays werden zurzeit unter definierten Szenarien für einen Einsatz zu regulatorischen Zwecken untersucht. Die Assays werden als wichtiger Beitrag zur Bewertung bei uneindeutigen Tierversuchsergebnissen gesehen. Durch die Revision der ICH S5(R3) ist nicht zu erwarten, dass mit den neuen Methoden der Tierversuch per se beendet wird, sondern unter bestimmten Umständen soll zu einem vollständigen Ersatz einer (der beiden) Tierspezies kommen können. Es soll zudem zu keinem zentralisierten Zulassungsprozess für die regulatorische Anerkennung qualifizierter alternativer Assays kommen, dieser bleibe “agenturspezifisch” (53).
Literatur:




 Dr. rer. nat.
Dr. rer. nat. Menschen für Tierrechte - Tierversuchsgegner Rheinland-Pfalz e.V.
Menschen für Tierrechte - Tierversuchsgegner Rheinland-Pfalz e.V.