Die meisten unserer Organe sind durch Barrieren gegen schädigende Einflüsse geschützt. Das heißt nicht, dass kein Stoff oder Signal in das Organ gelangt, sondern, dass die Natur bestimmte Mechanismen eingerichtet hat, die den Organismus vor Fremdeinflüssen schützen sollen. Das passiert auf der Haut genauso wie an der Augenhornhaut, an den inneren Organen wie Darm oder Lunge und am Übergang zum Gehirn oder an der Plazenta. Forscher wie Prof. Claus-Michael Lehr mit seinem Team sowie die Teilnehmer der Konferenz erforschen solche Barrieren, um sie ggfs. mit ihren pharmazeutischen Wirkstoffen überwinden zu können oder im Gegenteil dazu die Wirkung genau darauf zu beschränken.

Biological Barriers Kongress im Hörsaal der Pharmazeutischen Fakultät der Universität Saarbrücken.
Foto: HIPS.
Die Konferenzteilnehmer forschen daran, wie man die „Reise“ der Arzneimoleküle, sei es über ein Spray, Gel oder in Form eines therapeutischen Antikörpers effektiver gestalten kann. Denn nicht selten kommt z.B. viel zu wenig Wirkstoff im zu bekämpfenden Tumor an – für den Patienten eine fatale Entwicklung.
Daher ist es für die meisten der Forscher auch eine Selbstverständlichkeit, mit Zellkulturen zu arbeiten und dabei wenn es notwendig ist, immer komplexer werdende dreidimensionale Gewebekulturen zu entwickeln und die Barrieren ggfs. im Miniaturmaßstab nachzubilden. Solche Barriereforschung erfordert im Allgemeinen eben nicht ein Tiermodell. Sie sind lokal begrenzt und um die Mechanismen zu begreifen müssen alle anderen Faktoren weggelassen werden. Der genaue Mechanismus von Zellen und deren Bestandteile wie Rezeptoren, Signaltransduktionswege, Genregulatoren, mikroRNAs oder extrazelluläre Vesikel als Reaktion auf einen Fremdstoff sind hier gefragt.
Deshalb nahmen zum einen komplexer werdende Darm-, Lungen- oder Hautmodelle, Plazenta- und Blut-Hirnschrankenkulturen sowie in-vitro-Krankheitsmodelle - spätere pharmazeutische Wirkstoffe sollen letztlich den kranken Menschen zu Gute kommen - einen breiten Raum in der Konferenz ein. Zum anderen die Nanomedizin, die zur Überwindung der Barrieren bzw. gezielten Platzierung des Wirkstoffs beitragen sollen. Ein weiteres wichtiges Thema war die Etablierung von Bakterien in in-vitro-Modellen.
An dieser Stelle können nur einige exemplarische Beispiele an Forschungsergebnissen vorgestellt werden.
So gehören bei Prof. Heike Walles und ihrem Team aus Würzburg z.B. ein miniaturisiertes Blutgefäßsystem für ihre Haut- und Darmmodelle bereits zum Standard. Das Team hat zudem Lungen-, Darm- und Brustkrebsmodelle entwickelt, mit denen monoklonale Antikörper zur Behandlung der Krebserkrankung entwickelt werden sollen. Integrierte Bakterienkulturen z.B. in Infektionsmodellen werden genutzt, um zu untersuchen, wie es den Bakterien gelingt, die Barriere zu durchdringen. Verschiedene Lungen- und Nasenschleimhautmodelle dienen dazu, Nanopartikel mit schleimlösendem Arzneimittel „zu beladen“ und zu untersuchen, wie der Schleim verdaut wird. Humane Hautmodelle werden auch zur Erforschung der Entwicklung der TseTse-Fliege genutzt. Der Parasit befällt nur den Menschen und löst die sogenannte Schlafkrankheit aus.
Um die Funktion von Schleimhautbarrieren gegen Infektionen ging es bei der Forschung von Dr. Kathrin Ribbeck vom MIT in Boston: Sie hat herausgefunden, dass die Schleimhautbarriere zwar nicht die Anheftung von Bakterien verhindert, dafür aber die Biofilmbildung von Bakterien beeinträchtigt. Auch die Muttermundschleimhaut hat sie erforscht. Es gibt Fälle, bei denen eine schlechte Schleimhautqualität zu einem Aufstieg von Bakterien in die Gebärmutter während der Schwangerschaft führt, was eine Frühgeburt auslösen kann. Ein mikrofluidisches Organ-on-a-Chip-System dient hier der Erforschung des Bakterientransports durch die Schleimhaut.
Dr. Rana Abu-Dahab hat ein in-vitro-Modell der Mukoviszidose entwickelt. Lungenepithelzellen und Sputum als Schleimhaut wurden hier zusammen mit dem Testbakterium Pseudomonas aeroginosa, ein als Krankenhauskeim bekanntes Bakterium, kokultiviert. Mit dem Modell wurde dann ein Antibiotikum getestet. Die Forscherin konnte zeigen, dass die Lungenzellen besser überleben, wenn zuvor der Mucus den Bakterienbiofilm unterdrückt hat. Justus Horstmann von HIPS hat ein ähnliches Modell entwickelt.

Nachwuchswissenschaftler Justus Horstmann von HIPS stellt seine Entwicklung eines Mukoviszidosemodells vor.
Foto: Christiane Hohensee
Ein anderes Thema war Tuberkulose, an welcher laut Lungeninformationsdienst 2016 weltweit 10,4 Millionen Menschen erkrankt und 1,7 Millionen gestorben waren. Maximilian Guerterrez vom Francis Crick Institute konnte mit Hilfe eines in-vitro-Modells zeigen, dass sich der Tuberkuloseerreger mit einer Lipidschicht umgibt und Arzneimittel mit dieser Lipidschicht interagieren, nicht jedoch mit dem Lungenerreger selbst. So kommt es zu Behandlungsmisserfolgen. Im Organismus versteckt sich der Erreger in Lipidtröpfchen von Makrophagen.
Prof. Josué Sznitman vom Israel Institute of Technology in Haifa hält die derzeitigen in-vitro-Lungenmodelle für zu groß (2). Auch herkömmliche Modelle mit isolierten Lungenzellen und nachgebildeten Luft-Flüssigkeitsgrenzen durch submerse Zellkultur oder Transwell-Inserts mit permeablen Membranen werden kritisch gesehen. Die Modelle müssen eine realistische physiologische Atemwegsumgebung durch realistische Anatomie der Atemwege, Atemluftströme und ein zelluläres Aufbaupinzip schaffen. Mikrofluidische Lung-on-a-Chip-Systeme könnten hier hilfreich sein. Anstelle eines Lungenläppchens haben er und sein Team einen sogenannten Azinus auf dem Chip entwickelt. Ein Azinus ist die kleinste funktionelle Einheit eines Endabschnitts der Lunge. 12 Azini formen ein Lungenläppchen.
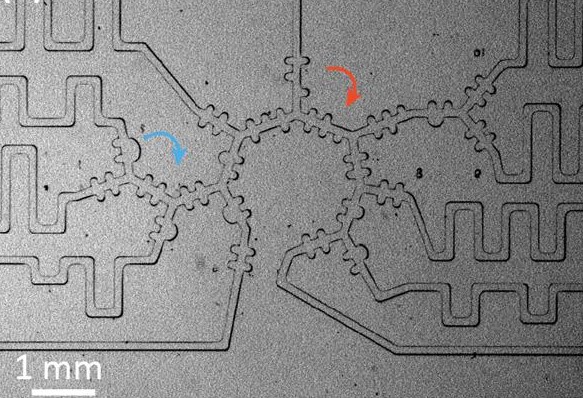
Atemwegsbaum der Alveole in einem mikrofluidischen System. In einem mikrofluidisches Modell zur Entwicklung von Atemwege auf der Ebene des Azinus werden sakkulare Alveolarräume angelegt (blauer Pfeil) und unteralveoläre Azinarkanäle (rote Pfeile). Entsprechend verlaufen die Luft- und Flüssigkeitsströme dynamisch z.B. mit Verwirbelungen.
Quelle: Tenenbaum-Katan et al. Biomicrofluidics 12, 042209 (2018). Creative Commons Attribution (CC BY) license (http://creativecommons.org/licenses/by/4.0/). https://doi.org/10.1063/1.5023034
Der Nachwuchswissenschaftler Gianpiero Lazzari vom Institut Galien der Université de Paris-Sud hat ein komplexes Pankreas-Modell in einem mikrofluidischen System entwickelt. Es besteht aus Fibroblasten, Bauchspeicheldrüsenkrebszellen und kleinste Blutgefäße in einer Matrix konstruiert (3). Das Tumormodell könnte zur Erforschung von Therapien auf der Grundlage von Nanomedizin genutzt werden.
Dr. Tina Buerki-Thurnherr von der Swiss Federal Laboratories for Materials Science and Technology (EMPA) erforscht mit Placentaorganoiden auf dem Chip, ob Nanopartikel die Plazentaschranke überwinden können. Nanopartikel als mögliche Verursacher von Umweltschäden sind noch nicht ausreichend erforscht. Die Forscher nehmen an, dass die Exposition mit Nanopartikeln während der Schwangerschaft einen schädigenden Einfluss auf den Fötus haben könnte. Dabei sind diese Partikel von der Größe von zwischen 1 und 100 Nanometern quasi aus unserem Lebensbereich nicht mehr wegzudenken und umgeben uns ständig. So sind sie z.B. als Putzkörper in Zahnpasta enthalten. Das Plazentamodell ist geeignet, um Penetrationsstudien durchzuführen.
Ebenfalls die Überwindung von Barrieren untersucht Dr. Joanna Reyman vom tübinger Unternehmen CureVac. Mittels eines humanen Lungenzellmodells erforscht sie, wie es gelingen könnte, sogenannte messenger RNA als eine Art Fähre zu benutzen, um ein gewünschte Arzneimittel in die Lunge zu bringen. Es ist nämlich gar nicht so einfach, da in der Regel extra- und intrazelluläre Barrieren Fremdstoffe daran hindern, hier hineinzukommen. Messenger DNA kommt bei der Proteinbiosynthese natürlicher Maßen in der Zelle vor und ist daher als Arzneistofflieferant in der Zelle interessant.
Prof. Jesús Pérez-Gil von der Complutense Universität in Madrid untersucht die grenzflächenaktive Substanz auf der Oberfläche der Lunge. Rund 90% der Substanz, die von Pneumozyten des Typs II gebildet wird, besteht aus Lipiden, der Rest aus Proteinen, zu denen auch Plasmaproteine zählen. Ein bestimmtes Plasmaprotein gilt seinem Interesse, weil es mit seinen Oberflächendomänen Fremdstoffe an Makrophagen „verpetzt“. Es hat also immunologische Funktion, weil die Nanopartikel, die als Trägerpartikel Arzneimittel zum Wirkort durch die Lungenbarriere bringen sollen, dann von den Makrophagen bekämpft bzw. verdaut werden.
Ein neues spannendes Thema ist die Charakterisierung und ggfs. der Einsatz von extrazellulären Vesikeln als drug delivery-Systeme. Extrazelluläre Vesikel sind Membranpartikel, die von jeder Zelle gebildet werden und von den verschiedensten Zellen wieder aufgenommen werden können. Sie können ohne weiteres biologische Barrieren durchdringen und tragen Proteine, DNA oder mikroRNA in sich. Dadurch spielen sie eine wichtige Rolle bei der intrazellulären Kommunikation im Gewebe. Der genaue Mechanismus ist noch nicht ausreichend bekannt. Je nach Größe unterscheiden Wissenschaftler zwischen Exosomen, Mikrovesikeln und apoptotischen Körperchen. Dr. David Carter von der Oxford Brookes University untersucht die Rolle von Exosomen bei der Stressreaktion von Zellen. Er fand heraus, dass bei Bestrahlung auch Nachbarzellen in Mitleidenschaft gezogen werden, obwohl sie dem Stress gar nicht ausgesetzt worden waren. Hintergrund ist, dass die Nachbarzellen Exosomen mit RNA der Stresszellen aufnehmen.
Bevor extrazelluläre Vesikel als drug delivery Systeme genutzt werden können, ist jedoch noch umfangreiche Forschung notwendig.
Die Beispiele zeigen deutlich, dass für die Entwicklung neuer notwendiger Therapien z.B. mit Hilfe der Nanomedizin die detaillierten Wirkmechanismen nur mit Hilfe von humanspezifischen, physiologischen Zell- und Gewebesystemen erforscht werden können.
Weitere Informationen:
(1) http://biobarriers.hips-wordpress.helmholtz-hzi.de/
(2) Janna Tenenbaum-Katan, Arbel Artzy-Schnirman, Rami Fishler, Netanel Korin & Josué Sznitman (2018). Biomimetics of the pulmonary environment in vitro: A microfluidics perspective. Biomicrofluidics 12, 042209.
(3) Gianpiero Lazzari, Valérie Nicolas, Michiya Matsusaki, Mitsuru Akashi, Patrick Couvreur & Simona Mura (2018). Multicellular spheroid based on a triple co-culture: A novel 3D model to mimic pancreatic tumor complexity. Acta Biomaterialia.
(4) Pharmazeuten treffen sich zur internationalen Konferenz „BioBarriers 2018“ in Saarbrücken. Pressemitteilung der Universität des Saarlandes vom 02.08.2018. https://idw-online.de/de/news700215.
(5) Holger Büchner (2018). "Wir sehen Potenzial, von Tierversuchen wegzukommen" - Ein Gespräch des Saarländischen Rundfunks mit Prof. Claus Michael Lehr, Experte für Biopharmazie und Pharmazeutische Technologie am Helmholtz-Zentrum für Pharmazeutische Forschung im Saarland (HIPS), 27.08.2018. https://www.sr.de/sr/sr2/themen/politik/20180827_prof_claus_biopharmazie_tierversuche_interview100.html.
(6) Arbeitsgruppe im Portrait: Helmholtz-Institut für Pharmazeutische Forschung Saarland (HIPS), Abteilung Wirkstoff-Transport. https://www.invitrojobs.com/index.php/de/forschung-methoden/arbeitsgruppe-im-portrait/item/3222-arbeitsgruppe-im-portrait-helmholtz-institut-fuer-pharmazeutische-forschung-saarland-hips-abteilung-wirkstoff-transport
