Die Verletzung eines Blutgefäßes führt über eine Signalkaskade im Blutplasma zu einer Freisetzung von Thrombin aus Prothrombin. Das Enzym aktiviert Gerinnungsfaktoren und Fibrin und schließt mit deren Hilfe die Wunde. In den Blutgefäßen kann es jedoch zu Blutgerinnseln (Thromben) und anderen Komplikationen kommen. Thrombin aktiviert u.a. auch den PAR-1-Rezeptor; aufgrund dieser Bindung kommt es zur Aktivierung und Aggregation der Thrombozyten (Blutplättchen).
Der Gegenspieler zum Thrombin ist u.a. das Protein C. Es wird im Normalfall aktiviert, nachdem Thrombin an Thrombomodulin, das an den Endothelzellen der inneren Wand der Blutgefäße lokalisiert ist, bindet (1). Es wirkt entzündungshemmend auf die Endothelzellen an der Blutgefäßwand und verdünnt das Blut wieder. Nun wird Protein C in abgewandelter Form auch medikamentös verabreicht, z.B. bei einem Herzinfarkt oder Verschluss der Beinarterien. Dies kann aber unter Umständen das Thrombin zu stark hemmen und am Ende zu Blutungen führen (2).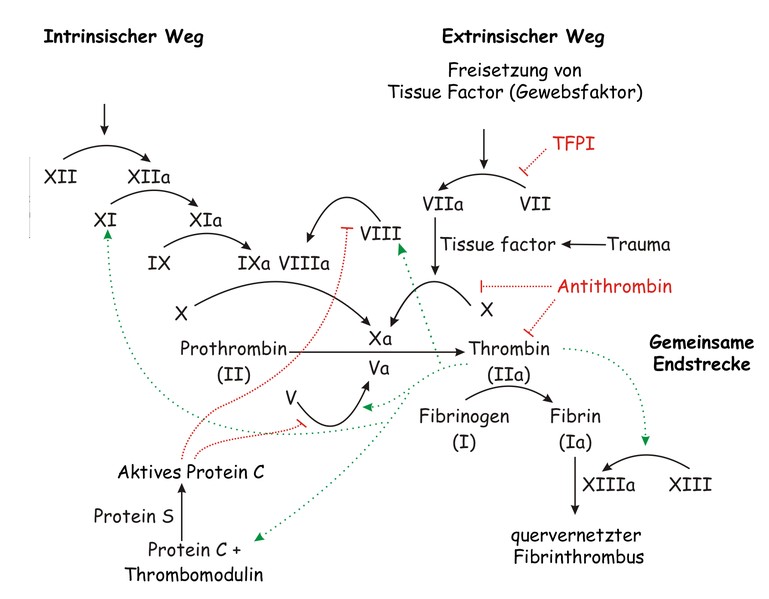
Ablauf der sekundären Blutgerinnung. Joe D, Wikipedia, 2007
Die Arbeitsgruppe Hämostase und Thrombose des Beth Israel Deaconess Medical Centers hat gemeinsam mit Wissenschaftlern des Wyss-Instituts der Harvard-Universität Boston kleine Moleküle, genannt Parmoduline, getestet, die das aktivierte Protein C simulieren können. Diese zeigen einen anti-entzündlichen und anti-thrombotischen Effekt, ohne jedoch den durch aktiviertes Protein C vermittelten Signalweg zu beeinflussen und die Endothelzellen negativ zu beeinflussen (3).
Dafür haben sie einen in vitro-Test eingesetzt, den blood vessel-on-a-chip. Auf ihm sind kleinste Mikrokanälchen parallel auf einem Mikrochip eingefräst, die mit Collagen bezogen und mit menschlichen Endothelzellen ausgekleidet wurden. Sie simulieren die Innenwand der menschlichen Blutgefäße. Durch die kleinen Kanäle können Vollblut und andere Substanzen geleitet werden. Die Forscher inkubierten die in vitro kultivierten Endothelzellen zunächst mit ihrem Parmodulin für mehrere Stunden und setzten die Zellen dann Lipopolysacchariden oder dem Botenstoff TNF-α aus, um die Bildung von Trombin auszulösen. Im Vergleich zu den Kontrollen war die Bildung von Thrombin um die Hälfte verringert. Dagegen hatten diese Moleküle keinen Einfluss auf den Blutgerinnungsfaktor V und X der Gerinnungskaskade, die für die Blutkoagulation verantwortlich sind. Es kommt demnach also nicht zu Blutungsphänomenen.
Mit dem Modell konnten sie die Wirkung der Thrombozytenaggregationshemmer (Parmoduline) auf die Endothelzellen untersuchen und nicht nur ermitteln, welche Signalwege beim Parmodulin ablaufen, sondern auch zeigen, dass Parmodulin vor einer Schädigung durch Entzündungsprozesse an den Endothelzellen schützt.
Das Forscherteam hat seine Arbeit im Journal Proceedings of the National Academy of Sciences vorgestellt.
Quelle:
https://wyss.harvard.edu/stop-the-clots-spare-the-coagulation/
(1) http://flexikon.doccheck.com/de/Protein_C
(2) http://www.pharmawiki.ch/wiki/index.php?wiki=Vorapaxar
(3) Omozuanvbo Aisiku, Christian G. Peters, Karen De Ceunynck, Chandra C. Ghosh et al. (2015): Parmodulins inhibit thrombus formation without inducing endothelial injury caused by vorapaxar. Blood. 125 (12): 1976-1985.




 Dr. rer. nat.
Dr. rer. nat. Menschen für Tierrechte - Tierversuchsgegner Rheinland-Pfalz e.V.
Menschen für Tierrechte - Tierversuchsgegner Rheinland-Pfalz e.V.