
Zur Diskussion der Frage „Verliert Deutschland den Anschluss“ trafen sich die Podiumsteilnehmer Prof. Roland Lauster, Dr. Robert Landsiedel und Dr. Mardas Daneshian. Links: Moderator André Tonn.
Foto: Christiane Hohensee
Bislang keine Anerkennung der Testrategien
Dr. Robert Landsiedel von BASF erklärte den Zuhörern, dass die Industrie in den meisten Fällen an die Durchführung von Tierversuchen nach EU-Vorgaben (REACh 1907/2006) gesetzlich gebunden ist. Die Abteilung der BASF hat über viele Jahre Ersatzverfahren zum Tierversuch entwickelt. Ersatzverfahren zum Tierversuch seien nicht zwangsläufig billiger, jedoch schneller und es würde weniger der entwickelten Testsubstanz verbraucht.
Bei der Entwicklung von Ersatzverfahren zu Tierversuchen komme es darauf an, dass die Testergebnisse reproduzierbar und relevant sind. Jedoch auch wenn alle Voraussetzungen erfüllt seien, reiche das für einen verpflichtende Anwendung noch immer nicht aus, denn auch die Regulationsbehörden müssen ebenfalls überzeugt sein und genau hier läge das Problem. Von der Entwicklung bis zum Einzug in die OECD-Testrichtlinie dauere es 10 Jahre.
Am Beispiel der Augen- und Hautreizungstests erklärte er, dass nicht einzelne Tests, sondern eine Batterie mehrerer, verschiedener Tests benötigt werde, um die notwendigen Testergebnisse in der notwendigen Qualität zu erhalten. Im Anerkennungsverfahren (Validierung) geprüft werden müsse nicht nur, ob die einzelnen Tests gut seien, sondern auch, ob die Abfolge der Testbatterie sinnvoll sei.
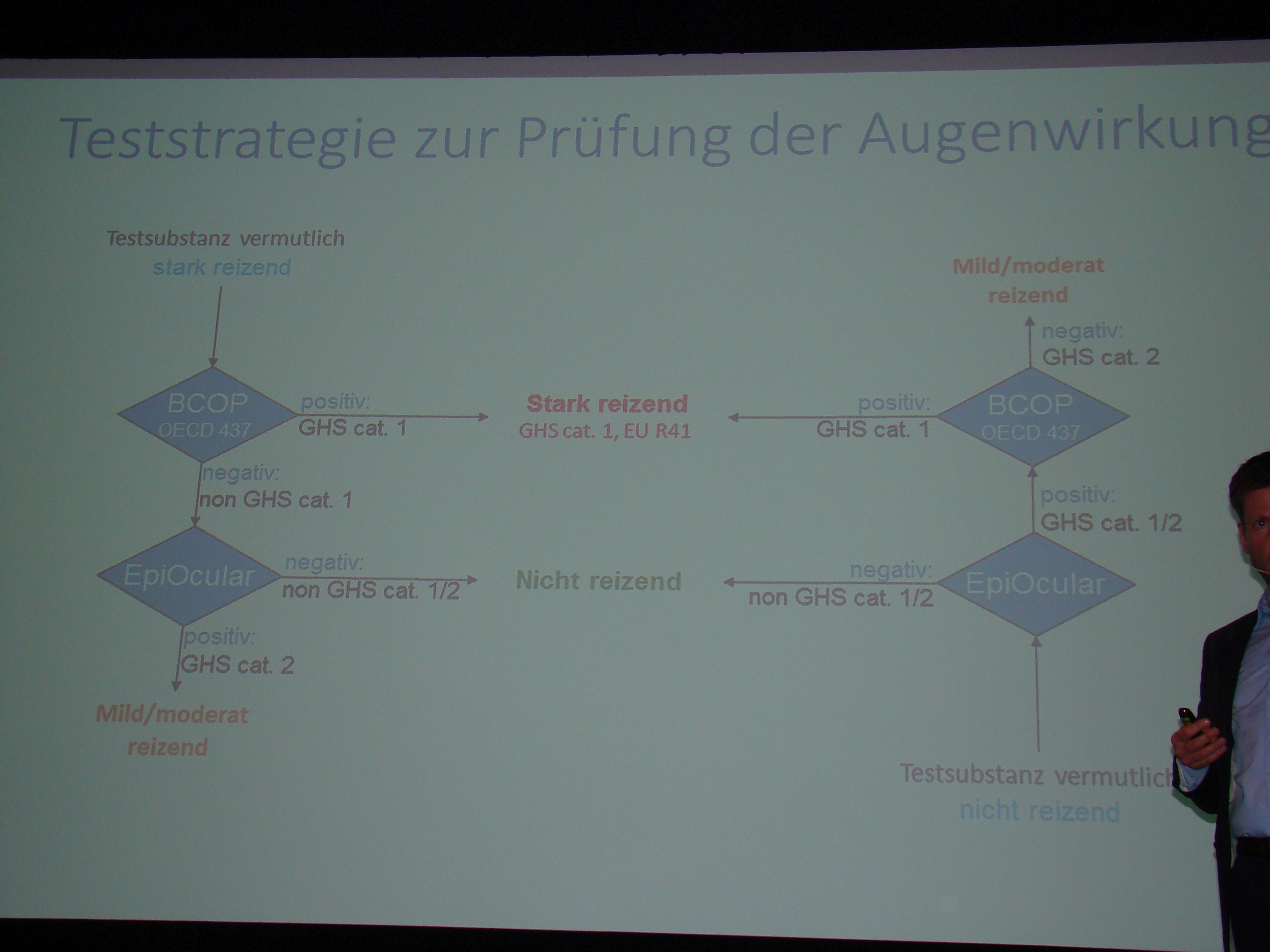
Zur Untersuchung einer Substanz auf starke Augenreizung hat Dr. Landsiedel und sein Team als Ersatzverfahren solch eine Testbatterie entwickelt, sie wurde aber bislang nicht vollständig anerkannt. Eeinerseits hat das Team den BCOP-Test entwickelt (Bovine Corneal Opacity Test, OECD-Testrichtlinie 437), bei dem die starke Augenreiz-/Augenätzwirkung an Hornhäuten geschlachteter Rinder in einer eigens entwickelten Apparatur, dem Opacitometer gemessen wird. Ist die Substanz stark reizend, dann lässt sich die Trübung der Hornhaut mit dem Gerät detektieren. Das Gerät wurde von BASF weiterentwickelt und wird mittlerweile von der Firma Duratec vertrieben. Ist die Substanz nicht stark reizend, kommt die von BASF entwickelte Teststrategie ins Spiel: in einem Folgetest, dem Epiocular-Test, ist festzustellen, ob die Substanz mild bzw. moderat reizend ist. Erst wenn dieser Test ebenfalls negativ ausfällt, wird geschlussfolgert, dass die Substanz nicht reizend ist.
Die OECD hat den BCOP-Test bereits seit dem 26. Juli 2013 anerkannt. Er ist in die OECD-Testrichtlinien als Ersatzmethode für den Test auf ätzende und stark reizende Eigenschaft aufgenommen worden, nicht jedoch der Folgetest EpiOcular als zweiter Schritt in der Teststrategie, der zwischen mild/moderat reizenden und nicht-reizenden Substanzen unterscheiden lässt. Der EpiOcular-Test ist ein humanes Gewebekonstrukt (obere Deckgewebeschicht des menschlichen Auges), bei dem die reizende Wirkung der Substanz in Form der Zytotoxizität gemessen wird. Die Zellen werden in eine Mikrotiterplatte eingegeben und nach der Substanz zusätzlich ein Farbreagenz aufgebracht. Die Zytotoxizität lässt sich durch eine Abnahme der Farbintensität messen. Der Test als solcher ist nach OECD Testrichtlinie 492 anerkannt, aber nicht in seiner Funktion innerhalb der Teststrategie, sondern als Alternative zum BCOP zum Test auf Augenreizung und starke Augenätzung von Substanzen, die nach dem Globally Harmonized System der UN nicht klassifiziert und gelabelt werden müssen.
Dr. Landsiedel stellt seine Teststrategie auf Augenwirkung vor.
Foto: Christiane Hohensee
Der Wissenschaftler hat anhand umfangreicher Untersuchungen festgestellt, dass der EpiOcular als zweiter Schritt innerhalb der Teststrategie sehr gut geeignet ist, zwischen nicht-reizend und mild-reizend unterscheiden zu können.
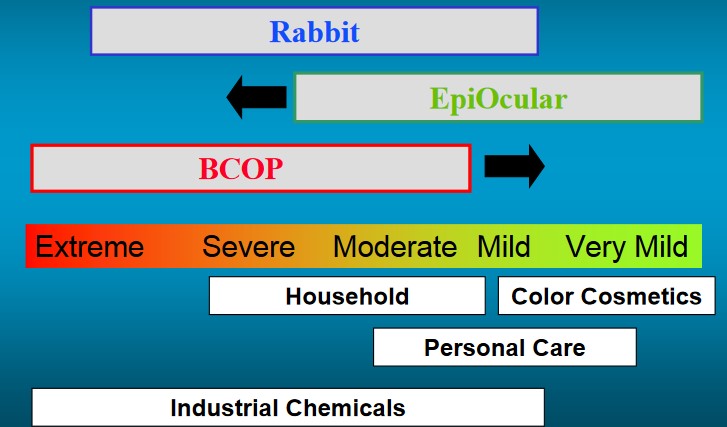
Im Gegensatz zum Kaninchentest decken die beiden Ersatzmethoden BCOP und Epiocular das gesamte Spektrum von Extrem Ätzend bis sehr mild reizend ab. Ist eine Substanz am Ende auch nicht sehr mild reizend, dann ist sie harmlos (nicht reizend). Die Teststrategie ist sowohl für Industriechemikalien, als auch für Haushaltsprodukte, Kosmetika und Pflegeprodukte einsetzbar und viel genauer.
Schema aus: Curren, Harbell & Truba (o.J.) The EpiOcular model: Protocol, Performance and Experiences.
Gemäß der Regulierungsbehörde führen jedoch die entwickelten Ersatzverfahren nicht zwangsläufig zu einer Reduzierung der Tierversuchszahlen, weil, wenn der BCOP-Test (oder der Epiocular-Test) negativ ausgefallen ist, der Augenreizungstest am Kaninchen durchgeführt werden soll, so Dr. Landsiedel im Vortrag. Die Regulationsbehörden ließen sich trotz der Testergebnisse von BASF nicht überzeugen, was hinsichtlich der letzten Stufe der nach REACh zu registrierenden Chemikalien den weiteren Verbrauch unzähliger Kaninchen – trotz vorhandener Einzeltests bedeutet.
Dasselbe passiere mit einer weiteren Teststrategie, nämlich im Bereich der Hautsensibilisierung, die das Leben einer Vielzahl an Meerschweinchen und Mäusen retten könnte: Wieder hat das Team um Dr. Landsiedel eine Teststrategie entwickelt, nach der eine mögliche hautsensibilisierende Eigenschaft einer Substanz mit mehreren abgestuften Tests Schritt für Schritt ermittelt werden kann. Hierfür hat das Team 2013 den Tierschutzforschungspreis des Bundesministeriums für Ernährung und Landwirtschaft erhalten (InVitro+Jobs berichtete darüber). Von den drei abgestuften Einzeltests ist der dritte (genannt h-CLAT) sowie die Teststrategie als solche von den Regulationsbehörden noch immer nicht anerkannt. Während der Tierversuch auf Sensibilisierung (sogenannter Local Lymph Node Assay (LLNA)) lediglich eine Vorhersagbarkeit von 89 % aufweist, liegt sie bei der Anwendung der Teststrategie mit den 3 Tests in abgestufter Abfolge bei 94 % - ein unschlagbarer Wert. Solange die Teststrategie nicht als Ersatzverfahren anerkannt ist, wird die Industrie auf den LLNA weiter durchführen.
Organ-on-a-Chip von der Industrie sehr gefragt
Prof. Roland Lauster von der Technischen Universität Berlin stellte Multi-Organ-Reaktoren im Chipformat vor, denen das Potenzial nachgesagt wird, Tierversuche in großem Maßstab ersetzen zu können. Dadurch, dass die menschlichen Organe aus unzähligen kleinsten Funktionseinheiten aufgebauten seien, ist es möglich, ist es möglich sie im Miniaturmaßstab 1:100.000 auf dem Chip nachzu“züchten“ und damit sowohl die Initiation der Organogenese als auch z.B. die Reaktion auf Chemikalien und Arzneimittel zu studieren. Dieser kleinste Maßstab benötige auch kein echtes Blutgefäßsystem, da der Stoffwechsel durch Diffusion erfolge. Das Herz wird hierbei durch ein 3-Membranen-Pumpensystem simuliert, um das Medium im Kreislauf zu halten. In Zukunft wollen die Forscher alle wichtigen Organe aus induzierten pluripotenten Stammzellen eines Spenders herstellen, wodurch es möglich wird, auch das Blut- und Lymphsystem zu integrieren. Die Entwickler, zu denen neben Prof. Lauster auch Dr. Uwe Marx und sein Team von TissUse gehören (InVitro+Jobs berichtete), sind mit ihren Organ-on-a-Chip-Systemen europaweit führend und bei der Industrie sehr gefragt. Zahlreiche namhafte Pharmafirmen haben angefragt, ob sie bereits charakterisierte Substanzen mit den Chipsystemen testen lassen können. Wenn die Ergebnisse zuverlässig sind, wollen sie ihre Tests auf die neuen, tierversuchsfreien Verfahren umstellen.
Das kontrovers diskutierte Titeltema wurde von Dr. Mardas Daneshian vom Center for Alternatives to Animal Testing vorgetragen. Er vertrat die Auffassung, dass Deutschland den Anschluss bei der Entwicklung von Ersatzverfahren zum Tierversuch verliere. Er präsentierte Beispiele dafür, dass Tierversuchsergebnisse nicht reproduzierbar seien, der Tierversuch sei schlichtweg nicht sicher und daher brauche man weltweit Alternativen zum Tierversuch. Die Pharmaindustrie würde durch hohe Investitionskosten in den Tierversuch und anschließende Misserfolge 330 Mrd. Euro Verlust gemacht haben, daher bestünde ein großes Interesse an neuen Methoden als Ersatz zum Tierversuch. Die neue Vision der Toxikologie im 21. Jahrhundert sehe vor, durch in-vitro- und in-silico-Methoden fragwürdige Substanzen zu evaluieren und damit den Tierverbrauch rapide zu reduzieren.
Zukünftige Human-on-a-Chip-Modelle, Analysen von Adverse Outcome Pathways und z.B. systemtoxikologische, virtuelle Ansätze: Solch ein komplexes Wissen benötige eine entsprechende Förderung, die in Deutschland fehle. Im Vergleich zur Forschung an Tieren und einem DFG-Etat von 1,92 Mrd. nehme sich die Förderung von Ersatzverfahren zum Tierversuch vergleichsweise gering aus. Großbritannien und die USA stellten weit mehr Fördermittel zur Verfügung. Allein für die Stammzellforschung werden in den USA rund 2 Mrd. Dollar zur Verfügung gestellt, für die Programme Human-on-a-Chip, ToxCast und ToxCast Data mehr als 305 Mio. Dollar. In Europa beträgt die Horizon 2020-Förderung zur Erforschung von Ersatzverfahren im Bereich der Langzeittoxizität und Entwicklungstoxizität gerade einmal 30 Mio. Euro.
Über die Ursachen wurde angeregt diskutiert und weniger die Politik als dann Personen in den Behörden als Bremser ausgemacht. Kreativität entstünde nur, wenn ein gewisses Kapital zur Verfügung stünde, mahnte Dr. Daneshian.
Quellen:
http://bookshop.europa.eu/en/eurl-ecvam-status-report-on-the-development-validation-and-regulatory-acceptance-of-alternative-methods-and-approaches-2015--pbLBNA27474/
http://www.oecd-ilibrary.org/environment/test-no-492-reconstructed-human-cornea-like-epithelium-rhce-test-method-for-identifying-chemicals-not-requiring-classification-and-labelling-for-eye-irritation-or-serious-eye-damage_9789264242548-en
http://www.iivs.org/workspace/assets/publications/120.pdf
