Arbeitsgruppe im Portrait: TissUse GmbH
TissUse besteht aus einem Team: Wissenschaftlicher Gründer, Geschäftsführer sowie Leiter des Multiorgan-Chip-Programms ist der Mediziner Dr. Uwe Marx. Neben TissUse hat er noch zwei weitere erfolgreiche Unternehmen mitgegründet: die ProBioGen AG und VITA34. Mit im Team ist Dr. Reyk Horland, Biotechnologe und spezialisiert auf Geschäftsentwicklung. Die Biochemikerin Dr. Silke Hoffmann ist die dritte im Team und zuständig für die Vermarktung von Rechten und Patentrechtsangelegenheiten. Sie verfügt über Expertise auf dem Gebiet der Vermarkung von gewerblichen Schutzrechten. Insgesamt besteht das Team aus 12 Mitarbeitern/Kollegen (Stand TissUse Juli 2015).
Abb. 1: TissUse-Gründer Uwe Marx (rechts) und MitarbeiterInnen.
Foto: Lutz Maternowski.
Natürlich könnten die drei die umfangreichen Entwicklungen nicht allein stemmen: Es existieren vielfältige Kooperationen z. B. mit der Technischen Universität Berlin unter der Leitung von Prof. Dr. Roland Lauster und seinem Team vom Fachgebiet Medizinische Biotechnologie, dem Stuttgarter Fraunhofer Institut für Grenzflächen und Bioverfahrenstechnik, dem Dresdener Fraunhofer-Institut für Werkstoff- und Strahltechnik oder auch der Universität Würzburg.
Das Besondere ist, dass jeder Wissenschaftler bzw. jede Forschungseinrichtung mit ergänzender Expertise eingeladen ist, an der Weiterentwicklung des Multi-Organ-Chips mitzuarbeiten.
TissUse1 wurde 2010 als Spin-Off aus der Technischen Universität Berlin gegründet. Hier wird die Idee eines humanen Organismus im Objektträger-Format weiterentwickelt und kommerzialisiert.
Abb. 2: TissUse sitzt in alten historischen Produktionsgebäuden der AEG in Berlin-Wedding.
Ansicht von der Gustav-Meyer-Allee aus.
Foto: Frisia Orientalis.
Gearbeitet wird an der Modellierung des menschlichen Organismus – am „Human-on a-Chip“
Seit 2013 sind die Forscher derzeit in der Lage, zwei Organe auf einem Chip miteinander zu verbinden und den „2-Organ-Chip“ kommerziell anzubieten. Die Zwei-Organ-Plattform wird längst weltweit von mehr als 20 wissenschaftlichen Einrichtungen bzw. Industrieforschergruppen wie Beiersdorf eingesetzt. Die Kommerzialisierung wird vom Bundesministerium für Forschung und Bildung (BMBF) im Rahmen der Förderinitiative GoBio mit 4,2 Millionen Euro unterstützt.
Die Zwei-Organ-Plattform besteht entweder aus Haut und Leber, Haut und Immunsystem oder aus einem anderen Organoid in Kombination mit der Leber, wie z.B. dem Nervengewebe. In den Chips findet das Leber-Organoid als Hauptstoffwechselorgan häufig Anwendung, weil die Leber im menschlichen Organismus eine Testsubstanz entgiften, aber im anderen Falle auch erst giftig machen kann. Die Verbindung der Organe untereinander erfolgt mithilfe von Mikropumpen, Kanälen und Membranen. Die Mikroorgane im Chip liefern schon jetzt Ergebnisse, die die natürliche Reaktion menschlicher Organe zum Beispiel auf Nebenwirkungen von Medikamenten, Kosmetika, Chemikalien oder anderen Produkten vorhersagbar machen, sodass damit bereits Tierversuche reduziert werden können.
Für die Entwicklung erhielt Dr. Uwe Marx Ende letzten Jahres den Tierschutzforschungspreis des Bundesministeriums für Ernährung und Landwirtschaft (BMEL)2.
Im realen Organismus durchläuft eine Substanz den Körper. Nachdem die Substanz nach oraler Verabreichung durch die Magen- bzw. Darmschleimhaut aufgenommen worden ist, gelangt sie über das Pfortadersystem in die Leber und wird hier verstoffwechselt. Ein Teil ist zur Ausscheidung vorgesehen, d. h. gelangt gar nicht zum Zielorgan. Der „Rest“ gelangt über die Lebervene wieder in den Blutkreislauf und wird zum Zielorgan weitertransportiert. Für diese wichtige Untersuchung wäre eine Zellkultur, die oft aus einem Zelltyp besteht, natürlich nicht geeignet.
Systemische Toxikologie
Die systemische Toxikologie betrachtet die Verteilung einer Substanz im Körper. Dabei kann die Substanz oral, dermal, intravenös o. ä. aufgenommen worden sein. Oftmals wird dabei ein (Zielorgan) geschädigt/beeinflusst.
Die Exposition, also das Ausgesetzt-Sein des Organismus wird in Dauern klassifiziert.
Die akute Toxikologie meint eine einmalige Exposition, subakut beschränkt die Exposition auf zwei Wochen oder einen Monat. Von chronischer Toxikologie dagegen spricht man, wenn der Organismus längerfristig der Substanz ausgesetzt ist, subchronisch z. B. drei Monate oder Jahre.

Abb. 3: Der 4-Organ-Chip von TissUse.
Foto: Christiane Hohensee
Gleichwohl haben solche Art Zellkulturen eine wichtige Funktion z.B. beim Screening von Substanzen auf ihre potenzielle Eignung. Außerdem haben Zellkulturen eine große Bedeutung bei mechanistischen Untersuchungen der Reaktion oder Biochemie der beteiligten Zellen.
Seit Ende 2014 sind die Wissenschaftler von TissUse in der Lage, vier Organoide auf einem Chip zu verbinden: Darm, Leber, Niere und Haut sind über kleinste Mikrokanälchen verbunden und werden über ein blutähnliches System versorgt. Dieser ADME-Chip (ADME= Absorption, Distribution, Metabolismus, Exkretion) ermöglicht bereits vergleichbare systemisch-toxikologische Untersuchungen, wie sie auch im Tier vorgenommen werden würden, wenn eine Substanz auf ihre schädlichen Auswirkungen bei wiederholter Applikation getestet werden würde. Insofern ist schon jetzt eine Reduzierung von Tierversuchen durch diese Plattformen möglich.
Letztlich sollen nach Möglichkeit ab Mitte 2018 10 oder mehr menschliche Organe auf der Chipplattform vertreten sein3: Darm, Leber, Bauchspeicheldrüse, Niere, Haut, Ovarien/Testis, Gehirn, Fettgewebe, Knochenmark das Blutsystem, sowie weitere Organe wie z.B. die Milz, wobei die Organe entsprechend ihrer physiologischen Gegebenheiten angeordnet sind. 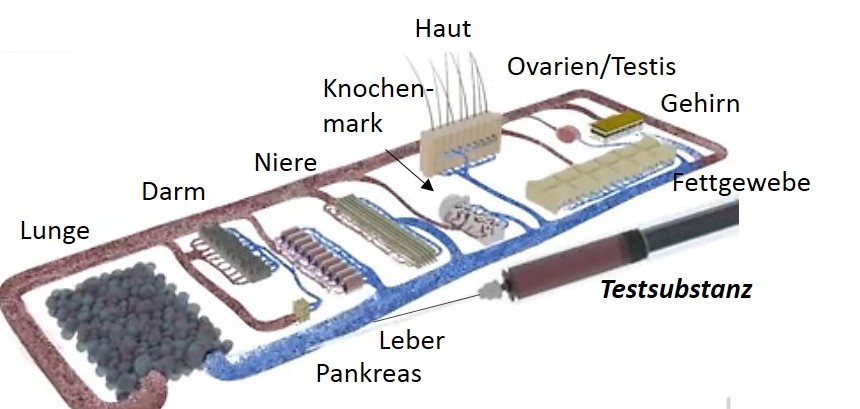
Abb. 4: 10 Organe auf einem Chip.
Grafik: TissUse.
Dabei verfügen die Organ-ähnlichen Ministrukturen nicht nur über die für ihre Funktion notwendigen Zelltypen, welche auch im richtigen Organ vorkommen, sondern die Zellen verfügen auch über die sogenannte „metabolische Kapazität“ wie es im natürlichen Organ der Fall ist. Die Pumpfunktion des Herzens wird durch eine integrierte Pumpe simuliert, welche im Kreislauf einen sogenannten pulsatilen Fluss erzeugt. Eine Testung potenziell kardiotoxischer Substanzen ist durch Verwendung von Herzmuskelzell-Kulturen möglich.
Neben der Möglichkeit, Substanzen oral (über den Darm), dermal (über die Haut) oder pulmonal (über die Lunge) zu applizieren, kann eine Substanz auch direkt in den Blutkreislauf eingebracht werden. Diese wird über die Blutbahn zur Leber transportiert und kann dort verstoffwechselt werden, bevor sie weiter transportiert wird. Sie gelangt von einem Organ zum nächsten und bis zum "Zielorgan", wobei studiert werden kann, ob das Zielorgan oder auch ggf. ein weiteres Organ angesprochen wird.
Die Organoide der Plattform können derzeit dabei 28 Tage lang immer wieder mit der Testsubstanz exponiert werden, so wie es bei repeated dose-Studien4 der Fall ist. Das entspricht den subakuten Toxizitätsstudien nach den OECD-Testrichtlinien5,6. So lässt sich jeden Tag die Wirkstoffdosis auftragen. In regelmäßigen Abständen lassen sich Blutproben oder Gewebebiopsien entnehmen, wie es auch im Tier vorgenommen wird. Nach Ablauf der 28-tägigen Expositionszeit werden die behandelten Organoid-Kulturen entnommen und untersucht.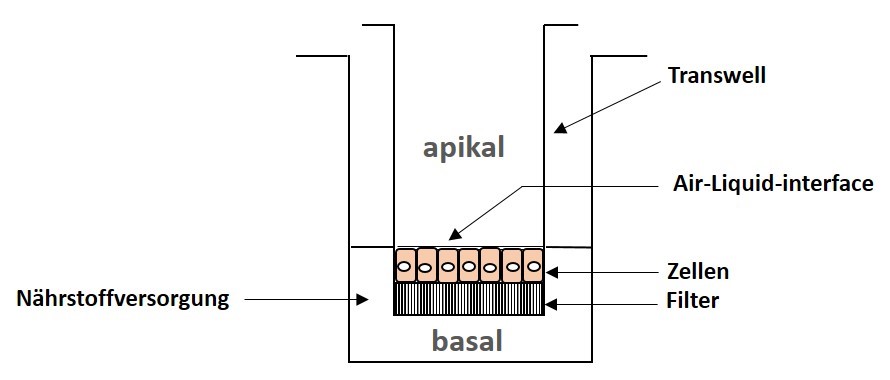
Abb. 5: Schema eines klassischen Transwell: Die klassische Variante der Zellkultivierung für die Exposition: die Zellen befinden sich auf einer mikroporösen Membran in Transwell-Inlays wobei alle lebenserhaltenen Funktionen wie Versorgung mit Medium, Temperatur, Gase etc. gewährleistet sind. Bei Haut- und Lungenzellgeweben stehen die Zellen an ihrer Oberseite wie in der Natur im unmittelbaren Kontakt mit der Umgebungsatmosphäre, während sie von der basalen Seite über die Membran mit Nährstoffen versorgt werden.
Schema: Christiane Hohensee
Wie werden Miniorgane erzeugt?
Eine geeignete Ausgangsbasis können Zelllinien oder Primärzellen sein, bzw. es können auch direkt Biopsien kultiviert werden. Ebenso können Vorläuferzellen für einen bestimmten Zelltyp oder induzierte pluripotente Stammzellen verwendet werden, die aus ausdifferenziertem Gewebe gewonnen, dann reprogrammiert und in den gewünschten Zelltyp differenziert werden. Zur Weiterentwicklung werden diese Zelltypen in entsprechenden Kulturmedien mit verschiedenen Nährmedien gezüchtet, die Wachstums- oder/und Differenzierungsfaktoren beeinhalten. Die Ausformierung von Mikrotissues z. B. in Form kleiner Kugeln (Sphäroide) mit einem Durchmesser von 100-500 Mikrometer hat sich bewährt7. Sphäroide können in einer Hanging-Drop-Kultur entwickelt werden. Am Beispiel der Leber finden sich in diesen Sphäroiden alle Zelltypen, die auch in einer echten Leber zu finden sind, also z. B. Hepatozyten, Endothel- und Immunzellen (Kupferzellen). Dabei ist nicht die Form entscheidend, sondern ihre Funktionalität, wie echte Organe auf Testsubstanzen reagieren zu können.
Aber auch andere Systeme haben sich als effektiv erwiesen, so z. B. schnur-ähnlich aneinandergereihte Hepatozyten, die die natürliche Polarität der Leberzellen aufrechterhalten und eine Trennung von den Galle-produzierenden Zellen ermöglichen7. Allerdings kommen im Moment die Organoide den Eigenschaften von Gewebebiopsien (Operationsreste von Patienten) lediglich nah7, können dafür aber 28 Tage lang kultiviert werden.
Ein Säugetier-Organ ist aus einer Vielzahl kleiner Einheiten aufgebaut, die innerhalb des Organs jeweils die gleiche und umfassende Funktion haben. Deshalb ist es möglich, einen Organismus in Miniatur mit umfassenden Organfunktionen überhaupt herzustellen. Diese kleinen Einheiten sind z.B. bei der Niere das Nephron, bei der Lunge der Alveolus und bei der Leber der Leberlobulus (Abb. 6, 8 und 9). 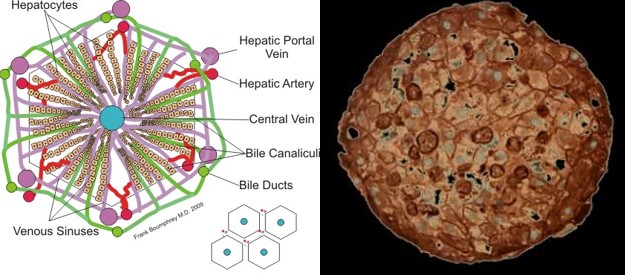
Abb. 6 links: Kleinste Einheit Leber: der Lobulus. Grafik: Boumphreyfr
Abb. 7 rechts: Querschnitt durch eine Lebersphäre. Foto: Insphero AG.
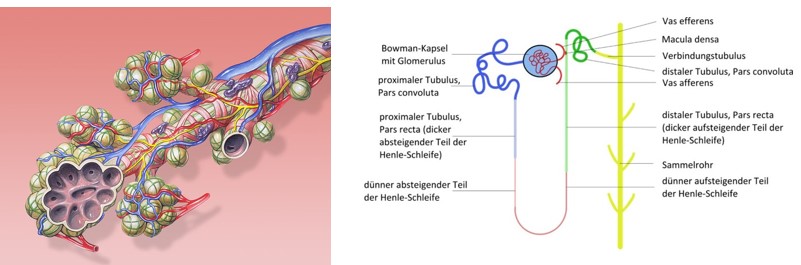
Abb. 8 links: Kleinste Einheit Lunge: Alveolus. Grafik: Patrick J. Lynch.
Abb. 9 rechts: Kleinste Einheit der Niere: das Nephron. Schema: Calibu28.
Auf die Plattformen können auch Organoide von Säugetierzellen aufgebracht werden, um ggf. eine Vergleichbarkeit mit bereits publizierten Tierversuchsergebnissen herzustellen. Erzielt werden soll jedoch ein humanspezifisches System, da die Testsubstanzen in der Regel auch dem Menschen zugutekommen sollen.
Der am Ende entwickelten Human-on-a-Chip soll dann in einer Vielzahl gleichzeitig exponiert und beprobt werden. Damit können im Vergleich zum Tierversuch aussagekräftigere Daten zur Sicherheits- und Effizienzbewertung von Substanzen vor Exposition am Menschen erhoben und somit erhebliche Kosten und Zeit gespart werden.
Abb. 10: Ziel ist es, unzählige kleine Human-on-a-Chip-Systeme in hoher Anzahl gleichzeitig zum Einsatz kommen zu lassen. Das führt zur immensen Zeit- und damit auch zur Kostenersparnis.
Grafik: TissUse.
Wieviel Tiere kann man ersetzen?
Letztliches Ziel ist es, möglichst alle Tierversuche im Bereich der akuten, subchronischen und chronischen Substanztestung ersetzen zu können (siehe Tabelle). Unter Einbeziehung der Tierzahlen für die „Krankheitsmodelle“ könnten noch weitaus mehr Tiere eingespart werden (siehe Interview unten).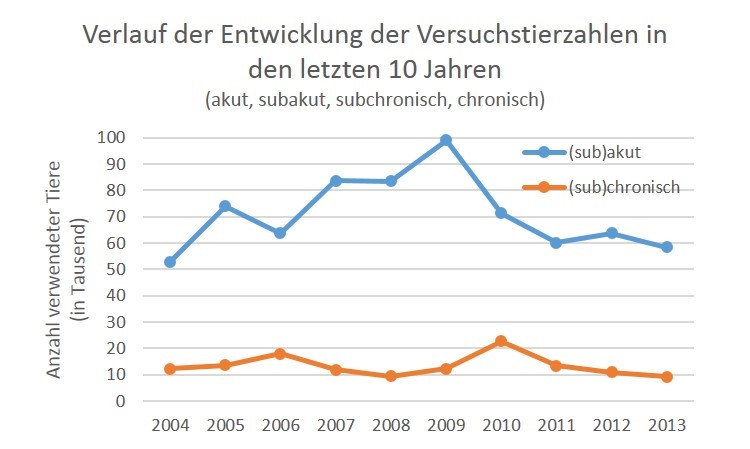
Abb. 11: Zahlen aus der Tierversuchsstatistik des BMEL 2013: Die Zahlen für die akute und chronische Toxizitätstestung verringern sich bislang nur leicht.
Grafik: Christiane Hohensee
Die Tierversuchszahlen gemäß der Tierversuchsstatistiken in Deutschland nehmen im Trend nur leicht ab8. Würden die Zahlen von 2013 zugrunde gelegt, wäre es potenziell möglich, mehr als 67.000 Tiere allein in Deutschland durch den Multi-Organ-on-a-Chip zu ersetzen. International wären es natürlich weitaus mehr (siehe Interview unten).
Tab.1: Übersicht über Testrichtlinien für Untersuchungen der systemischen Toxizität
OECD Testrichtlinien5,6
TG Nr. Beschreibung
402 Akute Toxizität (dermal)
403 Akute Inhalations-Toxizitäts-Studie
425 Akute Toxizität (oral), “Up-and-down-procedure (UDP)”
420 Akute Orale Toxizität – “Fixed Dose Procedure”
423 Akute Orale Toxizität – “Acute Toxic Class Method” (Stufen-Methode)
412 Subakute Inhalationstoxizität: Repeated Dose Inhalations-Toxizität 14‐Tage oder 28-Tage-Studie
407 Subakut: Repeated Dose 28‐Tage Orale Toxizitätsstudie in Nagetieren
410 Subakut: Repeated Dose Dermale Toxizität: 21/28‐Tage-Studie
408 Subchronische Studie: Repeated Dose 90‐Tage Orale Toxizitäts-Studie in Nagetieren
411 Subchronische dermale Toxizität: 90‐Tage Studie
413 Subchronische Inhalationstoxizität: 90‐Tage Studie
452 Chronische Toxizitäts-Studie
Wieviel Zeit muss noch veranschlagt werden?
Es wird darauf hingearbeitet, mit den ersten Studien 2018 zu beginnen. Eine Möglichkeit der Validierung15 ist dabei, bei der mehrere internationale Labore, die nichts voneinander wissen, Substanzen, die sie nicht kennen, mit dieser Chip-Technik testen und nach Möglichkeit zu vergleichbaren Ergebnissen kommen. Ist dies der Fall, lassen sich diese Plattformen großflächig im Hochdurchsatzverfahren zur Testung der systemischen Toxizität von Substanzen als neue Methode als Ersatz zum Tierversuch nutzen.
Mittel- und Langfristige Perspektive: Krankheitsmodelle und Grundlagenforschung
Eine Nutzung des Human-on-a-Chip zur Emulation von Krankheitsmodellen ist für erste Studien bereits in Planung. Hat sich die Plattform mit gesunden Organoiden erst einmal etabliert, ist es nur noch ein kleiner Schritt zur Entwicklung von komplexen Krankheitsmodellen der Leber, der Niere, des Gehirns etc.
Einzelansätze dazu gibt es bereits9,10,11.
…„Es ist ein Open innovation approach“…
InVitro+Jobs sprach mit Dr. Reyk Horland über den gegenwärtigen Stand und die zukünftigen Perspektiven des Human-on-a-Chip.
InVitro+Jobs: Wie ernst hat man anfangs das Thema genommen, einen künstlichen humanen Testorganismus zu schaffen?
Reyk Horland: 2010 begannen wir relativ einzigartig. Die deutschen Gutachter haben das Projekt schon von Anfang an im Rahmen der GoBio-Initiative gefördert. 2012 präsentierten die Amerikaner die Idee des „Human-on-a-Chip“. Involviert sind da DARPA12, NIH13 und die FDA14. Einzigartig dabei ist die Beteiligung der FDA als beratende Behörde, um bereits frühzeitig regulatorische Vorgaben für die Technologie einzubringen. Eine Summe von knapp 140 Millionen US-Dollar für 5 Jahre und zwei Gruppen im Wettbewerb (das MIT und das Wyss-Institute) sind natürlich im Vergleich zu europäischen Fördermaßnahmen eine hohe Investition. Für die Plattformen entwickeln verschiedene Arbeitsgruppen die einzelnen Organoide.
InVitro+Jobs: Wer arbeitet noch an einem Human-on-a-Chip?
Reyk Horland: Inzwischen wird weltweit daran geforscht mit z. B. sehr starken Initiativen in der Schweiz, den Niederlanden und Russland.
InVitro+Jobs: Gibt es da Unterschiede in der Vorgehensweise zwischen den internationalen Forschergruppen?
Reyk Horland: Man kann hier tendenziell zwei verschiedene Trends beobachten: 1.) Die Entwicklung von Einzelorganlösungen (Organ-on-a-Chip), um diese später in einem gemeinsamen Kreislauf miteinander zu verbinden, oder 2.) Die Entwicklung einer universellen Multi-Organ-Plattform-Technologie, die es erlaubt, mehrere Organmodelle im korrekten Gewebe:Gewebe- und Gewebe:Flüssigkeit-Verhältnis zu kultivieren. Diesen Ansatz verfolgen wir.
InVitro+Jobs: Die Aufgaben sind ja sehr umfangreich. Sind Sie in der Lage, diese ganzen Entwicklungen allein zu stemmen? Wer arbeitet denn daran mit?
Reyk Horland: Die Entwicklung von Human-on-a-Chip Systemen verlangt einen äußerst interdisziplinären Ansatz. Wir kooperieren z. B. sehr eng mit Ingenieuren im Bereich der Mikrofluidik und der Mess- und Regeltechnik. Spannend an diesem „Open Innovation Approach“ ist dabei, dass man mit den unterschiedlichsten Experten zusammenarbeitet und dabei ein gemeinsames Ziel verfolgt.
InVitro+Jobs: Welche Endpunkte können mit ihrem Chipsystem gemessen werden?
Reyk Horland: Die Endpunkte sind ähnlich denen im Tierversuch. Wie bei einer Blutentnahme lassen sich aus dem Medium alle physiologisch relevanten Parameter untersuchen wie Viabilität der Zellen, Stress, Veränderungen bei den Stoffwechselprodukten. Am Ende werden die Organoide entnommen vergleichbar der Organentnahme im Tier und die Zellen auf Schäden, Entzündungen, Genexpressionen, RNA usw. untersucht.
InVitro+Jobs: Wie kann man in so einem Miniatursystem kleine Gefäße auskleiden? Sie müssen ja die Elastizität aufweisen wie es auch beim Menschen den Fall ist.
Reyk Horland: Wir konstruieren kleinste künstliche Blutgefäße, die Gefäßwände werden mit humanen Endothelzellen ausgekleidet. Dadurch reagieren die Gefäße beim Vorbeiströmen von Substanzen und humanem Blut mit seinen Proteinen wie menschliche Blutgefäße.
InVitro+Jobs: Wieso wird als eines der vorgesehenen Organe Fettgewebe verwendet? Das ist doch eigentlich kein Organ oder?
Reyk Horland: Fettgewebe hat eine wichtige Speicher- und Stoffwechselfunktion und ist somit z.B. für die Emulation von Krankheitsmodellen interessant.
InVitro+Jobs: Wieviel Tiere, meinen Sie, könnte man mit Ihrer Entwicklung einsparen?
Reyk Horland: Die EU-Daten von 2011 beziffern 800.000 Säugetiere allein für die Toxizitätstestung von Chemikalien. Dazu kommen noch einmal 5 Millionen für die Effizienzbewertung von pharmazeutisch wirksamen Substanzen. Alle Tiermodelle sind allerdings nicht einzusparen: Kognitive Bewertungen bei neurodegenerativen Erkrankungen z. B. sind nicht ersetzbar.
InVitro+Jobs: Wann soll der vollständige Human-on-a-Chip denn nutzbar sein?
Reyk Horland: Der erste Prototyp soll 2018 für erste Studien verfügbar sein.
InVitro+Jobs: Wie sieht die Finanzierungssituation derzeit aus?
Reyk Horland: Jetzt am Ende der ersten GoBio-Förderphase hat das System hervorragend funktioniert. Wir befinden uns gerade in der Investitionsrunde des Spin-offs16 für die zweite Förderphase. Zusätzlich versuchen wir, Drittmittel, z.B. über die Europäische Horizon 2020- Ausschreibungen zu akquirieren.
InVitro+Jobs: Wenn sich Studenten bei ihnen bewerben wollen: Was müssen sie mitbringen?
Reyk Horland: Im Moment gibt es einen großen Bedarf an Zellkulturexpertise, um Organmodelle auf dem Chip zu etablieren. An Vorkenntnissen wäre Erfahrung in humaner Zellkultivierung von Primärzellen und Erfahrungen mit deren Ansprüchen wichtig. Generell freuen wir uns aber über jeden Bewerber, der mit seiner Expertise einen Beitrag zur Entwicklung der Technologie leisten will.
Dann wären Erfahrungen mit Mikrofluidik wichtig, um neue Chipeigenschaften entwerfen zu können. Bei unserem Kooperationspartner, dem Fraunhofer IWS benötigt man Kenntnisse in Mikrofluidik, E-Technik und im Gerätebau.
InVitro+Jobs: Wir danken für das Gespräch.
Literatur oder Websites:
1 http://www.tissuse.com/
3 TissUse (2014): Multi-Organ-Chips revolutionieren Medikamenten-Tests. Pressemitteilung vom 13. August 2014.
6 http://alttox.org/mapp/toxicity-endpoints-tests/acute-systemic-toxicity/
7 Materne, E., Tonevitsky, A.G. & Marx, U. (2013): Chip-based liver equivalents for toxicity testing – organotypicalness versus cost-efficient high throughput. Lab on a Chip 13: 3481-3495.
8 Versuchstierstatistik des BMEL (2013): http://www.bmel.de/SharedDocs/Downloads/Tier/Tierschutz/2013-TierversuchszahlenGesamt.pdf?__blob=publicationFile
12 EPA: U.S. Environmental Protection Agency, http://www.epa.gov/
13 NIH: Amerikanisches National Institute of Health, http://www.nih.gov/
14 FDA: U.S. Food and Drug Administration, http://www.fda.gov/
15 Validierung: Durch die Validierung wird der dokumentierte Beweis erbracht, dass ein Prozess oder ein System die vorher spezifizierten Anforderungen (Akzeptanzkriterien) reproduzierbar im praktischen Einsatz erfüllt (http://de.wikipedia.org/wiki/Validierung_%28Pharmatechnik%29)
16 Spinn-off: Ausgliederung einer Organisationseinheit aus einem Unternehmen oder einer Universität. http://wirtschaftslexikon.gabler.de/Definition/spin-off.html
Zusätzlich wird auf die Publikationen der Arbeitsgruppe verwiesen. Sie sind auf InVitro+Jobs gelistet:
http://invitrojobs.kommzept.de/index.php/de/technologien/lab-on-a-chip-systeme




 Dr. rer. nat.
Dr. rer. nat. Menschen für Tierrechte - Tierversuchsgegner Rheinland-Pfalz e.V.
Menschen für Tierrechte - Tierversuchsgegner Rheinland-Pfalz e.V.