Arbeitsgruppe im Portrait:
Helmholtz-Institut für Pharmazeutische Forschung Saarland (HIPS),
Abteilung Wirkstoff-Transport
In dieser Ausgabe stellen wir die Abteilung „Wirkstoff-Transport“ des Helmholtz-Instituts für Pharmazeutische Forschung Saarland (HIPS) unter der Leitung des Professors für Biopharmazie und Pharmazeutische Technologie der Saar-Universität, Prof. Dr. Claus-Michael Lehr, vor.
Insbesondere vor dem Hintergrund der zunehmenden Bedrohung durch Infektionskrankheiten untersucht das Team die Eigenschaften von biologischen Barrieren des menschlichen Körpers und, wie man sie überwinden kann, um Arzneimittel an die Stelle zu bringen, wo sie am Ende wirken sollen. Biologische Barrieren wirken als Schutz des Körpers gegen Umwelteinflüsse (Noxen), lassen jedoch selektiv auch Stoffe durch, die der Körper benötigt (1). Zu den Barrieren gehören die Haut, der Darm, die Mundschleimhaut und die Lunge.
Für ihre Untersuchungen entwickelt das Team in vitro-Methoden. Die Wissenschaftler gehen davon aus, dass nur human-spezifische Testmethoden zu zuverlässigen und sicheren Arzneimittel-entwicklungen führen können.

Abb.: 1 Abteilung Wirkstoff-Transport von Prof. Claus-Michael Lehr am Helmholtz-Institut für Pharmazeutische Forschung Saarland (HIPS).
Quelle: HIPS
Ziel ist die Entwicklung neuer Medikamente, insbesondere Anti-Infektiva und Impfstoffe. Dies ist wichtig, denn es gibt einen Mangel an wirksamen Medikamenten gegen derartige Krankheiten. Außerdem nimmt die Zahl von Krankheitserregern, die resistent gegen gängige Arzneimittel sind, weiter zu (2).
Prof. Lehr untersucht den gezielten Wirkstofftransport zum Krankheitsherd. Dabei werden einerseits die Eigenschaften der biologischen Barrieren (Haut-, Lungen- und Darmbarriere) selbst untersucht. Beispiel: Die Schleimschicht der Bronchien lässt zwar Gase und winzigste Partikel leicht passieren, bremst aber größere Teilchen wie Wirkstoffe aus. Um die Zeit abzuschätzen, die nötig ist, um bei Inhalation eines Arzneimittels diese Barriere zu überwinden, helfen auch mathematische Modelle. In Kooperation mit der Arbeitsgruppe von Prof. Christian Wagner (Physik, Universität des Saarlandes) konnte ein neues mathematisches Modell entwickelt und damit vorhergesagt werden, dass es 15 Minuten dauert, bis ein Nanopartikel in Kugelform mit einem Durchmesser kleiner als 30 bis 40 nm den Schleim durchdrungen hat (3).
Abb.: 2 Nanofähre in Maisform.
Foto: Marc Schneider/cc-NanoBioNet/Deutscher Verband Nanotechnologie
Zum anderen wird auch an geeigneten Transportsystemen geforscht, um die genannten Barrieren zu überwinden und einen Wirkstoff zum Zielort zu bringen. Beispiel: Da Nanopartikel, wie an den Gitterstäben eines Käfigs, an steifen, dicken Gelstäben des Lungenschleims hängen bleiben, haben sich die Forscher Nanofähren ausgedacht wie diese z.B., die aussieht wie ein Maiskolben (Abb. 2). Die Röhre ist 10 µm lang, die außen befestigten Kügelchen 800 Nanometer im Durchmesser. An ihnen sollen später Wirkstoffe aufgebracht werden, die den Lungenschleim überwinden können (4).
Das Wissenschaftlerteam um Prof. Claus-Michael Lehr entwickelt Modelle, mit denen Mechanismen von Infektionskrankheiten untersucht und Arzneimittel getestet werden können, so u.a. eine neue humane Alveolarzelllinie, die in ihren Eigenschaften der Luft-Blut-Barrierefunktion die in-vivo-Situation im Menschen gut darstellen kann. Die Alveolen sind die Lungenbläschen und für den Gasaustausch in der Lunge verantwortlich (siehe Kasten unten), können aber auch sehr kleine Partikel in den Blutkreislauf weiterleiten. Alveolaren bestehen aus zwei Zelltypen, genannt Alveolarzelltyp I und II. Das hier entwickelte Modell besteht aus dem Zelltyp I, der für die Ausbildung der Barriere zwischen Blut und Luftraum der Lunge zuständig ist (siehe Abbildung 6). Dem Team gelang es, diesen Zelltyp mit Hilfe eines Lentivirus zu immortalisieren und so eine Zelllinie zu schaffen. Sie kann genutzt werden, um die Wirkung von eingeatmeten Substanzen zu testen, die bereits die oberflächlichere Bronchial-epithelbarriere mit Schleim und Zilien überwunden haben (5). Dabei wird der sogenannte transepitheliale Widerstand der Zellen gemessen. Für den Fall, dass Substanzen oder Arzneimittel diese Barriere durchschreiten können, werden Erkenntnisse über die Mechanismen in tieferen Lungenschichten dringend benötigt (6).

Abb. 3: Auch chromatografische und massenspektrometrische Analysen werden nach Transport-, Wirkstofffreisetzungs- und Stabilitätsversuchen mit in-vitro-Lungenmodellen durchgeführt.
Foto: HIPS/Bellhäuser.
Inhalierbare Arzneimittel, bei denen das Medikament über die sog. „Luft-Blut-Schranke“ in den Blutkreislauf gelangt sind für Arzneimittelentwickler durchaus attraktiv: Im Vergleich zu anderen Organen hat die Lunge eine relativ geringe Enzymaktivität. Außerdem kann der kleine Leberkreislauf umgangen werden, der eine Substanz verstoffwechselt, wodurch sie je nachdem entgiftet, oder aber auch erst giftig gemacht werden kann, was dann zu unerwünschten Nebenwirkungen führen würde (1).
Die Forschung steckt jedoch erst in den Anfängen. Die Forscher wissen bislang zu wenig über den weiteren Verbleib von inhalierten Arzneimitteln und deren Trägerpartikel, also darüber, ob sie durch das Alveolarepithel durchtreten oder spezifische Bereiche oder Zellen in der Lunge überhaupt erreichen.
Prof. Lehr ist Träger zahlreicher Preise, u.a. des Tierschutzforschungspreises des Bundesministeriums für Ernährung, Landwirtschaft und Verbraucherschutz (2011) und des Landes Rheinland-Pfalz (2011), die er zusammen mit seinem Team für die Entwicklung eines chronisch-entzündlichen Darmmodells in der Petrischale erhielt. 2015, 2016 und 2017 wurde er vom Fachmagazin Medicine Maker dreimal in Folge zu einem der hundert einflussreichsten Experten im Bereich der Arzneimittel-Entwicklung gekürt. 1998 hat er zusammen mit Dr. Eleonore Haltner das Spin-off Unternehmen Across Barriers gegründet, das mittlerweile 36 Mitarbeiter beschäftigt. Hier werden Untersuchungen für die pharmazeutische, kosmetische und chemische Industrie mit in-vitro Modellen von human-spezifischen Zell- und Gewebesystemen angeboten, die den Transport von Substanzen und Formulierungen über biologische Barrieren simulieren können. Er ist zudem Mitgründer und Geschäftsführer der im Jahr 2010 gegründeten PharmBioTech GmbH in Saarbrücken, einem gemeinnützigen Tochterunternehmen der Universität des Saarlandes. Die Abteilung „Wirkstoff-Transport“ am Helmholtz-Institut für Pharmazeutische Forschung Saarland leitet er seit 2009.
Die Lunge: Versorgungs- und Entfernungsorgan
Der Körper gewinnt Energie durch oxidativen Abbau von Nährstoffen und braucht daher eine ständige Sauerstoffzufuhr (7). Dafür ist die Lunge zuständig. Gleichermaßen sorgt sie für den Abtransport von Stoffwechselendprodukten, insbesondere von CO2. Eine weitere, wichtige Aufgabe ist die Entfernung von Fremdpartikeln aus der Lunge (Barrierefunktion).
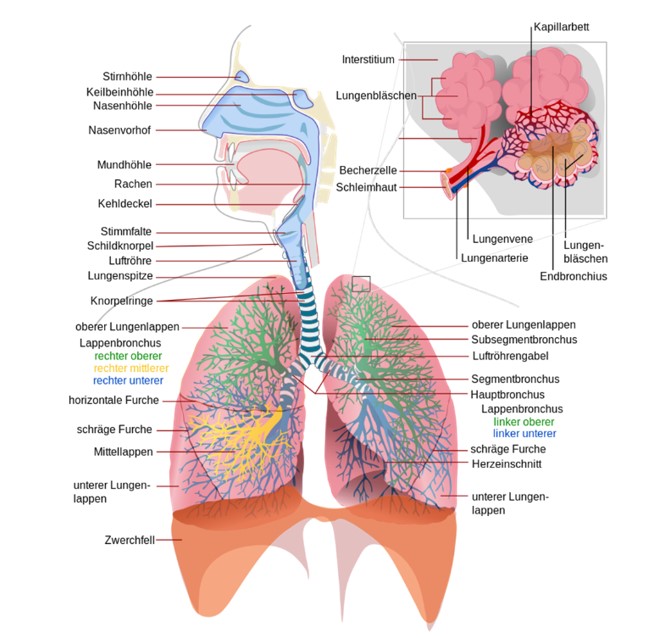
Abb. 4: Überblick über den menschlichen Atemtrakt.
Grafik: LadyofHats, Wikipedia.
Der gesamte Atemtrakt besteht aus Nase, Rachen, Luftröhre, dem linken und rechten Hauptbronchus und mündet in den rechten und linken Lungenflügel (8). Luftröhre und Bronchien sind mit einer Schleimhaut und Flimmerhärchen ausgekleidet.
Das Respirationsepithel besteht aus mehreren Reihen von Epithelzellen und kleidet den überwiegenden Teil des Atemtrakts aus. Auf der Innenseite (Lumen-seitig) der Zelloberfläche befinden sich Flimmerhärchen (Kinozilien). Außerdem gibt es innerhalb des Epithels sogenannte Becherzellen, das sind Drüsenzellen zwischen den normalen Epithelzellen. Sie produzieren Schleim, der an die Epitheloberfläche lumenwärts abgegeben wird. Diese Schleimauskleidung ist eine Schutzschicht, die als Barriere gegen Bakterien und Partikel wirkt (9). Mit Hilfe der Schleimschicht soll der Durchtritt von Partikeln verhindert werden. Flimmerhärchen fegen im Normalfall die Partikel wieder nach draußen. Hinzu kommen endokrine Zellen, die Serotonin und Peptide ausscheiden, mit denen sie die Geschwindigkeit der Schleimsekretion und Zilienschläge beeinflussen können (10). Sogenannte Clubzellen sezernieren Proteine, die die dabei helfen, überschießende Entzündungsvorgänge zu dämpfen. Auch Immunzellen gibt es in der Lunge: Alveolarmakrophagen - wanderungsfähige Fresszellen - verdauen Fremdstoffe, die in den Alveolarbereich vorgedrungen sind (1, 11). Hiernach werden diese gefüllten Alveolarmakrophagen mit dem Schleim aus der Lunge hinausbefördert (10). Die Oberfläche der Lunge ist zudem mit einer mikrobiellen Flora, der sog. Mikrobiota besiedelt, die durch Umwelteinflüsse verändert werden kann und einen Einfluss auf die Immunabwehr ausübt (12, 13), zudem aber auch einen Einfluss auf den Fremdstoffmetabolismus ausüben kann. Die Alveolen sind aus einschichtigen Alveolarepithelzellen, Typ 1 und Typ 2, aufgebaut. Beim Einatmen wird die Luft zunächst nur durch ein sich ständig weiter verzweigendes Röhrensystem geleitet, an dessen Ende die Alveolargänge liegen, die den eigentlichen Respirationsbereich darstellen. In den Alveolen (Lungenbläschen) erfolgt der Gasaustausch durch Diffusion (7).
Typ 1-Zellen bilden in den Lungenbläschen eine dünne Zellschicht, die an die Wandzellen der Lungenkapillar-zellen grenzen. Sie bilden die Blut-Luft-Schranke. Hier diffundieren Sauerstoff und Kohlendioxid. Der Alveolarzelltyp 2 dagegen stellt den Surfactant dar. Der Surfactant besteht aus Lipiden und Proteinen, die die Oberflächenspannung vermindern und das Zusammenfallen und Verkleben der Alveolen beim Ausatmen verhindern (14).
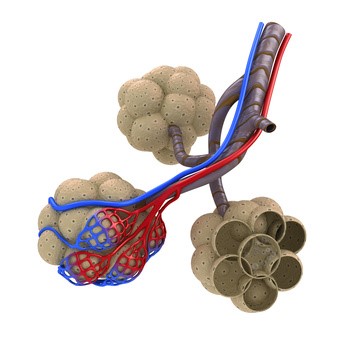
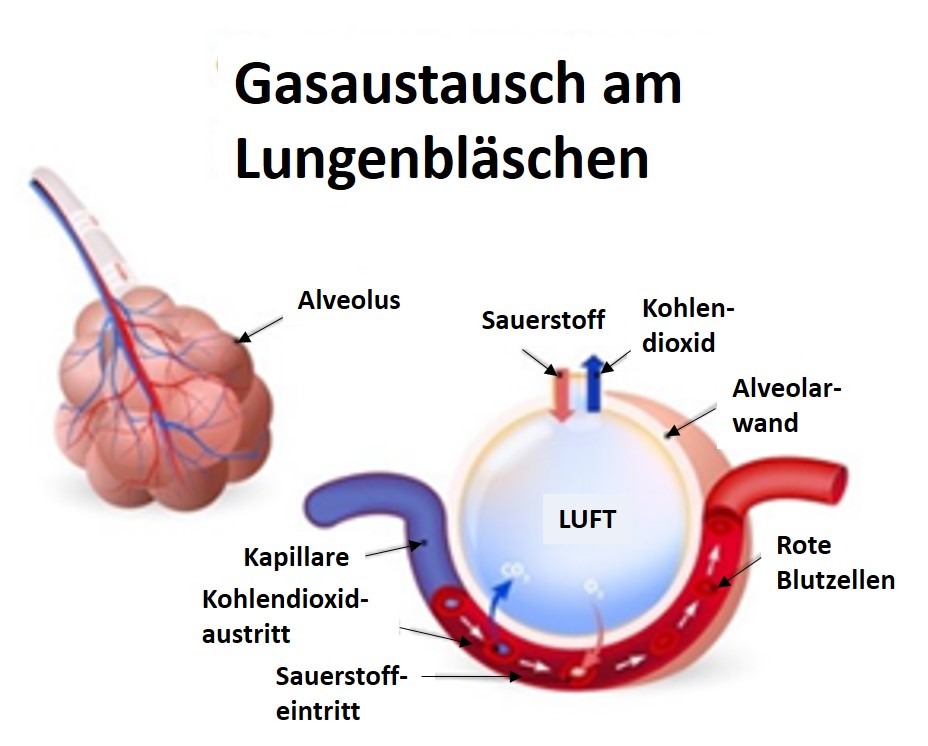
Abb. 5 links: Alveolen mit Kapillarnetz. Grafik: Alexandr_Mitiuc, Fotolia.com
Abb. 6 rechts: Längsschnitt durch eine Alveole. Gasaustausch am Lungenbläschen. Grafik: designua
Prof. Lehr entwickelt in vitro-Modelle mit humanen Zellen sowohl der Atemwege (Bronchialepithel) als auch der sog. tiefen Lunge (Alveolarepithel) mit dem Ziel, mit neuen Wirkstoffen Lungenerkrankungen behandeln zu können. Und das ist dringend notwendig.
Lungenerkrankungen nehmen zu
Weltweit gehören Lungenerkrankungen mit zu den Hauptauslösern von Todesfällen nach Herzinfarkt und Schlaganfall. Allen voran spielen die Lungenentzündung, die chronisch-obstruktive Lungenerkrankung (COPD), Lungenkrebs und Tuberkulose eine Rolle. In Europa sollen diese Erkrankungen für ein Zehntel aller Todesfälle im Jahr 2008 verantwortlich gewesen sein (15).
Es gibt genetisch bedingte Erkrankungen wie Mukoviszidose oder ein Mangel an a1-Antrypsin (a). Viele Lungenerkrankungen jedoch, wie Asthma, chronische Infektionen oder COPD, resultieren aus einer jahrelangen berufsbedingten Exposition und einem belastenden Lebensstil (Rauchen). Durch Kombination aus genetischer Veranlagung und umweltbedingten Einflüssen kann z.B. COPD oder Lungenfibrose entstehen. Ein Drittel aller COPD-Fälle soll dabei auf Luftverschmutzungen zurückzuführen sein, sagen Forscher. Das trifft nicht nur Schwellenländer.
Zunehmende berufsbedingte Exposition gibt es in Europa vor allem mit dem Salz Diisocyanat (16), das für die Herstellung von Schaumstoffen z.B. genutzt wird und Beryllium, das in Form einer Legierung mit Kupfer oder anderen Metallen zur Herstellung von Werkstoffen genutzt wird (17). Berylliumfeinstaub kann in bestimmten Fällen zu einer BerylIiose oder „Chronic Beryllium Disease” (CBD) mit Beeinträchtigung der Lungenfunktion führen (18).
Die sich entwickelnden, gefährlichsten Mechanismen sind oxidativer Stress sowie lokale und systemische (b) Entzündungsprozesse in der Lunge. Nach Inhalation und Adsorption toxischer Sulfat-, Nitrat- oder Metallpartikel entstehen zuerst reaktive Sauerstoffmoleküle in den Lungenzellen. Partikel und stark oxidierende Gase wie Ozon und Stickoxide können lokale Reaktionen in der Lunge auslösen, die zu oxidativem Stress führen. Lokale und systemische Entzündungsreaktionen werden durch Zytokine und Chemokine des körpereigenen Immunsystems ausgelöst. Dabei ist das Resultat eines fortschreitenden Gewebeumbaus mit Verlust der Architektur eine Lungenfibrose. Ein dauerhafter Entzündungsstimulus versursacht irreparable Schäden und Funktionsverluste. Als Ursache wird eine unkontrollierte Produktion des Zytokins IL13 angenommen (19), das bei allergischen Reaktionen auftritt. IL13 soll auch der Hauptmediator für Asthmaanfälle sein (20).
Es werden unzählige Tierversuche sowohl in der Giftigkeitsprüfung als auch in der Arzneimittelentwicklung durchgeführt
In Untersuchungen zur Giftigkeit von Gasen und Stäuben in erster Linie Ratten eingesetzt. Das Versuchstier in der Grundlagen- oder translationalen Forschung sind vor allem Mäuse. In der Grundlagen- und angewandten Forschung werden Behandlungsmöglichkeiten für akute Lungenschäden, Lungenentzündungen, Lungenfibrosen und Lungentumore gesucht (21).
Giftigkeitsprüfungen
Giftigkeitsprüfungen von Gasen und Stäuben sind gesetzlich vorgeschrieben nach den Testrichtlinien der OECD 403 (akute Inhalationsstudie), 433 (akute Inhalationsstudie mit festgelegten Substanz-konzentrationen), 436 (akute Inhalation, Klassifizierungsmethode), 412 (subakute, 28 Tage-Studien) und 413 (subchronische, 90 Tage-Studien). Die Untersuchungsergebnisse dienen der Risikobewertung im Umgang mit diesen Substanzen (Arbeitsschutz), eine Einstufung der Substanzen (Chemikalien) und ihre Kennzeichnung auf Verpackungen und in Sicherheitsdatenblättern.

Für toxikologische Studien gibt es zwar weltweit zahlreiche Entwicklungen von humanen Zellkulturen oder Organ-on-Chip-Modellen. In Einzelfällen ist sogar schon der gesamte menschliche Respirationstrakt in-vitro abgebildet worden (22). Auch Immunzellen wurden bereits integriert (23, 24) und einige Entwickler haben bereits Validierungsstudien durchgeführt (25) oder befinden sich in derartigen Studien (26).

Trotzdem ist bislang kein Verfahren zum Ersatz von Tierversuchen anerkannt worden und in die Gesetzgebung eingeflossen. Es wird argumentiert, dass Zellsysteme z.B. nicht das komplexe Zusammenspiel zwischen Lunge und einem anderen Organ oder von biochemischen, physiologischen, anatomischen Prozessen und zuvor erhobener Biomarker in Blut oder Sputum abbilden können. Kurzum: Inhalation betrifft den Körper systemisch.
Demnach benötigen Ersatzverfahren zum Inhalationstest am Tier neben der Nachbildung der Lunge auch wenigstens ein oder mehrere nachgebildete Miniorgane und eines funktionierenden (Blut-) Kreislaufs, in den die Substanz über die Alveolen abgegeben wird. Das Human-on-a-Chip genannte System wird derzeit noch mit Hochdruck entwickelt z.B. bei TissUse in Berlin.
Da zur Untersuchung auf Inhalationstoxizität sowohl lokale als auch systemische Tests durchgeführt werden müssen, haben Teilnehmer eines 2016 durchgeführten Workshops in den USA zum Thema empfohlen, zunächst einmal eine Datenbank mit bereits vorhandenen akuten systemischen Toxizitätsdaten aufzubauen, ein Review über aktuellste Toxizitätsmechanismen und Testmethoden zu verfassen, die in vitro-Assays zu optimieren sowie Standardprotokolle für deren weltweite Anwendung in Laboren zu erstellen (27).
Da die derzeitigen Entwicklungen noch nicht ausreichen, haben Regulationsbehörden zumindest versucht, den Tierverbrauch zu reduzieren. Aus den USA und Canada kam ursprünglich der Vorschlag, bei bestimmten Fällen auf Tierversuche im Bereich der akuten Toxikologie, das sogenannte Six-Pack, (Inhalationstoxikologie, orale Toxikologie, Hautätzung, Hautreizung, Hautsensibilisierung und Augenätzung) komplett zu verzichten und sie ggfs. mit tierversuchsfreien Methoden zu ersetzen. Mittlerweile gab es dazu mehrere Treffen auf OECD-Ebene und ein Guidance-Dokument wurde verfasst, indem nachzulesen ist, auf welche Fälle der Verzicht angewandt werden kann (28).
Das Journal Applied In Vitro Toxicology wird in Kürze eine Sonderausgabe zum Thema Implementierung alternativer Ansätze für Tests auf Inhalationstoxizität herausbringen (29).
Krankheits- und Arzneimittelforschung (Grundlagen- und angewandte Forschung)
Bei der Erforschung von Lungenerkrankungen und möglicher Behandlungsansätze werden ebenfalls noch immer Tierversuche durchgeführt. Ein Beispiel ist die sogenannte A/J Maus (c). Der Inzuchtstamm ist weit verbreitet und wird in einer Vielzahl an Untersuchungsgebieten eingesetzt, so in Karzinogenitätstests, weil er leicht Lungentumore ausbildet (30) oder zur Erforschung von COPD (d) oder einem Lungenemphysem, da A/J-Mäuse nach Exposition mit Zigarettenrauch viel schneller als andere Mausstämme ein Emphysem ausbilden (31). Jedoch geht der Trend unweigerlich zu sogenannten disease-on-Chip-Modellen.
Für die in-vitro-Krankheitsforschung entwickeln Forscher z.B. Krebsmodelle. Ein dreidimensionales Lungenkrebsmodell beispielsweise (32) vereint menschliche Bronchialzellen, die von Patienten gewonnen wurden, mit Bindegewebszellen der Lunge und Adenokarzinomzellen der Lunge. Die entstehenden kleinen Tumorknötchen arbeiten sich im Laufe der Zeit durch das gesunde Gewebe durch. Damit lassen sich mögliche Therapieoptionen untersuchen. In einem anderen Modell, bei dem gesunde menschliche Bronchialepithelzellen genetisch verändert werden, können einzelne Frühstadien der Krebsentwicklung untersucht werden (33). Auch ein Multi-Organ-Chip mit Lunge, Leber und Herz ist bereits entwickelt worden, um die gegenseitigen Beeinflussungen der organähnlichen Systeme und dadurch bedingte Veränderungen von Arzneimittelwirkungen zu studieren (34).
Mittlerweile sollen einige Arzneimittelhersteller sogar ganze Abteilungen mit Organ-on-Chip-Systemen bestückt haben, die allerdings nicht dem Ersatz von Tierversuchen, sondern zunächst deren Reduktion dienen, indem ungeeignete Substanzen im Vorfeld besser aussortiert und nicht in den präklinischen Versuchsablauf mit dem Tier gehen.
Forscher wie Prof. Lehr haben hier maßgeblich mit ihren Modellentwicklungen auch bereits die Industrie überzeugen können.
Wir sprachen mit Prof. Claus-Michael Lehr über die in-vitro-Modelle in der Lungenforschung und seine Einschätzung der zukünftigen Perspektiven von tierversuchsfreien Methoden Organ-on-Chip-Systemen.
InVitro+Jobs: Herr Prof. Lehr: Sie haben einmal formuliert, dass Tierversuche für Ihr Forschungsgebiet nicht unbedingt am besten geeignet sind: Weshalb nicht?
Prof. Lehr: Zunächst muss man festhalten, dass in bestimmten Phasen der Arzneimittelentwicklung Tierversuche vorgeschrieben sind und deshalb nicht einfach weggelassen werden können, solange keine validierten Ersatzmethoden zur Verfügung stehen. Andererseits ist die Übertragbarkeit von Ergebnissen aus Tierexperimenten auf den Menschen oftmals sehr schlecht. Deswegen ist es – nicht nur aus gesetzlichen Gründen oder aus Motiven des Tierschutzes, sondern auch im Hinblick auf die schnellere Verfügbarkeit und von besseren und sicheren Medikamenten für schwerkranke Patienten – sehr wichtig an solchen Alternativmethoden zu forschen.
InVitro+Jobs: Antragsteller auf Tierversuche argumentieren sehr häufig, dass sich ihre Fragestellungen nur am ganzheitlichen Organismus untersuchen lassen. Wieso ist das bei Ihnen nicht notwendig?
Prof. Lehr: Probleme des Arzneistoff-Transports entstehen typischerweise an bestimmten biologischen Barrieren. Soweit sich diese in geeigneter Weise im „Reagenzglas“ nachbilden lassen, hat man dann durchaus einen Vorteil gegenüber der sehr komplexen „black box“, die einen Gesamtorganismus darstellt, insbesondere weil man für viele Barriere-Modelle auch menschliche Gewebe heranziehen kann und damit die Übertragbarkeit solcher Ergebnisse vom Tier auf den Menschen entfällt.
InVitro+Jobs: Weiß man eigentlich schon genug über die menschliche Lunge, um sie simulieren zu können?
Prof. Lehr: Die Lunge ist von ihrer Physiologie her sehr komplex und als biologische Barriere noch nicht so gut verstanden wie etwa die Haut oder der Darm. Trotzdem wurden auch hier bei der Entwicklung von in-vitro Modellen in den letzten Jahren sehr gute Fortschritte gemacht.
InVitro+Jobs: Sie entwickeln Ersatzverfahren zum Tierversuch für Inhalationstests: Wie viele haben Sie entwickelt und was kann man damit untersuchen?
Prof. Lehr: Bis ein Testsystem, welches möglicherwiese auf der Grundlage unserer Forschungsarbeiten entstehen wird, als tatsächliche Alternativmethode zur Verfügung stehen und bestimmte Tierversuche tatsächlich überflüssig machen kann, wird noch sehr viel Zeit vergehen. Trotzdem kann man aber auch schon mit den derzeitigen Modellen sehr viel über ein neues Medikament erfahren. Dies verkürzt Entwicklungszeiten, spart unnötige Fehlschläge und letztendlich dadurch auch schon jetzt durchaus einige Tierversuche.
InVitro+Jobs: Wann braucht man welche Modelle?
Prof. Lehr: Dies kommt – allein schon bei der Lunge - ganz auf die Fragestellung an: Geht es etwa um die Optimierung der Deposition inhalierter Medikamente in der Lunge, um deren anschließende Absorption über die sog. Luft-Blut-Schranke ins Blut, oder um die Clearance aus dem Luftraum der Lunge durch Bronchialschleim und Zilien bzw. durch Fresszellen? Für jede dieser Fragen braucht man im Grunde jeweils ein anderes, ganz spezielles Modell.
InVitro+Jobs: Sie arbeiten hauptsächlich auf dem Gebiet der Medikamentenentwicklung. Kann man die Modelle auch für die Giftigkeitsprüfungen (Inhalationstoxikologie) einsetzen?
Prof. Lehr: Da bekanntermaßen der Unterschied zwischen einem Medikament und einem Gift nur in der Dosis liegt, ist dies natürlich grundsätzlich möglich. Allerdings muss man bei der Prüfung von Medikamenten unterscheiden, ob es sich um den Nachweis der Wirksamkeit oder um den der toxikologischen Sicherheit geht. Bei Kosmetika und Chemikalien geht es eigentlich nur um den letztgenannten Aspekt.
InVitro+Jobs: Es gibt eine Vielzahl an Modellen bis hin zu komplizierten organähnlichen Systemen auf dem Chip oder solchen, die Atem-ähnliche Bewegungen ausführen können. Können Sie abschätzen, warum derartige Modelle noch nicht gesetzlich anerkannt sind?
Prof. Lehr: Das hat verschiedene Gründe. Zum einen sind derartige Modelle – bei allem Respekt vor und teilweise sogar Bewunderung der dahinterstehenden wissenschaftlichen Leistung – derzeit noch mit vielen Mängeln behaftet. Zum zweiten muss man, sofern diese Mängel in augenscheinliche befriedigendem Umfang behoben sind, die Zuverlässigkeit der mit solchen Modellen gewonnen Daten wissenschaftlich beweisen. Diese sogenannte „Validierung“ ist sehr zeit-, arbeits- und kostenaufwendig. Zum dritten ist es durchaus diskutabel, wie hoch man die Hürde legt, um eine bestimmte Methode tatsächlich als einem Tierversuch äquivalent anzusehen. Dabei stellt letzterer ja eigentlich auch nur einen Schätzwert für die tatsächlich interessierende Wirkung am Menschen dar. Am Ende sind es also nicht nur eine rein wissenschaftliche, sondern vor allem auch politisch-gesellschaftliche Fragen, wobei letztlich – wie z.B. auch beim Thema Treibauseffekt und CO2-Emissionen - neben ethischen Aspekten auch wirtschaftliche Interessen mit hineinspielen.
InVitro+Jobs: Ein Unternehmen in Genf hat inzwischen den gesamten Respirationstrakt von der Mundhöhle bis zu den Alveolen quasi in der Petrischale entwickelt. Geht der Weg dahin?
Prof. Lehr: Offensichtlich ein sehr spannender Ansatz, der schon aufgrund der anspruchsvollen Technologie fasziniert. Ob er am Ende praxistauglich ist, wird sich noch zeigen müssen.
InVitro+Jobs: Wie kompliziert müssen die Modelle sein? Wann reichen ggfs. einfache Modelle aus?
Prof. Lehr: Grundsätzlich sicher immer so einfach wie möglich und nur so kompliziert wie nötig. Gerade Letzteres ist aber sehr schwer einzuschätzen, wenn man das System, für das man versucht ein Modell zu bauen, im Grunde noch nicht ganz verstanden hat. Wir müssen uns immer klarmachen, dass wir noch immer weit davon entfernt sind, ein Lebewesen, ein Organ, ein Gewebe oder auch nur eine einzige lebende Zelle zu bauen.
InVitro+Jobs: Gerade hat ein Wissenschaftsteam einen Vorschlag für einen adverse outcome pathway für die Respirationssensibilisierung entwickelt. Dabei untersuchten sie niedermolekulare Chemikalien, zu denen auch Arzneimittel gehören. Sie empfahlen die Entwicklung einer Teststrategie und orientierten sich dabei etwas an den Methoden der Hautsensibilisierung. Was halten Sie von diesem Vorgehen. Ist das auch für Ihre Arbeit zukünftig ein gangbarer Weg?
Prof. Lehr: Das ist ein durchaus rationaler Ansatz, den ich sehr gut nachvollziehen kann.
InVitro+Jobs: Es gibt Wissenschaftler, von denen werden Tierversuche zusätzlich als Bedingung verlangt, damit sie ihre Forschung veröffentlichen können. Haben Sie dies auch schon einmal erlebt?
Prof. Lehr: Ja, es existiert namentlich bei einigen sehr angesehenen Zeitschriften eine gewisse Voreingenommenheit, dass man Forschungsergebnisse zu neuen Arzneimitteln erst dann als hinreichend relevant betrachtet, wenn sie an einem Tiermodell zustande kamen. Das ist zwar einerseits intuitiv nachvollziehbar, andererseits kann es aber sein, dass Ergebnisse aus Tierversuchen in vivo sich möglicherweise weniger gut auf die klinische Situation am Patienten übertragen lassen als solche aus bestimmten in vitro Modellen, die aber dafür auf humanen Zellen und Geweben basiert sind.
InVitro+Jobs: Ist es schwieriger, an Fördermittel zu gelangen, wenn Sie mit Zellkulturmodellen und Computersimulationen arbeiten wollen?
Prof. Lehr: Erfreulicherweise gibt es – aus den oben genannten Gründen sehr zurecht – durchaus öffentliche Fördermittel, Stiftungen und sogar Preise die der Erforschung alternativer oder Ersatzmethoden zum Tierversuch gewidmet sind.
InVitro+Jobs: Wir danken für das Gespräch.
Literatur:
(1) Gordon, S., Daneshian, M., Bouwstra, J. et al (2015): Non-Animal Models of Epithelial Barriers (Skin, Intestine and Lung) in Research, Industrial Applications and Regulatory Toxicology. ALTEX 32 (4): 327-378. DOI: http://dx.doi.org/10.14573/altex.1510051.
(3) Matthias Ernst, Thomas John, Marco Guenther, Christian Wagner, Ulrich F. Schaefer, Claus-Michael Lehr (2017): A Model for the Transient Subdiffusive Behavior of Particles in Mucus. Biophysical Journal 112/1: 172–179. http://dx.doi.org/10.1016/j.bpj.2016.11.900
(4) Kohler, D., Böttcher, S., Krüger, M., Lehr, C.-M., Möhwald, H. & Wang, D. (2011): Template-assisted polyelectrolyte encapsulation of nanoparticles into dispersible, hierarchically nanostructured microfibers, Advanced Drug Delivery Reviews. 23: 1376–1379. doi:10.1002/adma.201004048.
(5) Murgia, X., Loretz, B., Hartwig, O., Hittinger, M. & Lehr, C. M. (2017): The role of mucus on drug transport and its potential to affect therapeutic outcomes. Adv Drug Deliv Rev. 2017 Oct 26. doi: 10.1016/j.addr.2017.10.009. https://doi.org/10.1016/j.addr.2017.10.009
(6) Kuehn, A., Kletting, S., de Souza Carvalho-Wodarz, C., Repnik U., Griffiths, G., Fischer, U., Meese, E., Huwer, H., Wirth, D., May, T., Schneider-Daum, N. & Lehr, C.-M. (2016): Human alveolar epithelial cells expressing tight junctions to model the air-blood barrier. ALTEX 33/3: 251-260. http://www.altex.ch/all-issues/issue/3-16/human-alveolar-epithelial-cells-expressing-tight-junctions-to-model-the-air-blood-barrier
(7) Thews, G. & Vaupel, P. (2005): Vegetative Physiologie. Springer Verlag, Heidelberg.
(8) Cheers, G. (ed.) (2000): Anatomica. Global Book Publishing Pty. Ltd. Deutsche Ausgabe 2004. Tandem Verlag GmbH, Potsdam.
(9) http://flexikon.doccheck.com/de/Respiratorisches_Flimmerepithel
(10) Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts; K. & Walter, P. (2011): Molekularbiologie der Zelle. 5. Auflage. Verlag Wiley Blackwell.
(11) Wennemuth, G. (2012): Taschenatlas Histologie. Urban & Fischer, München.
(12) Gollwitzer ES, Saglani, S, Trompette A, Yadava K, Sherburn R, McCoy KD, Nicod LP, Lloyd CM & Marsland BJ (2014): Lung microbiota promotes tolerance to allergens in neonates DP-L1. Nat Med. 20 (6) :642-647. doi: 10.1038/nm.3568.
(13) Yun, Y, Srinivas, G, Kuenzel, S, Linnenbrink, M, Alnahas, S, Bruce, KD, Steinhoff, U, Bainesm JF & Schaible UE (2014): Environmentally Determined Differences in the Murine Lung Microbiota and Their Relation to Alveolar Architecture. PLOS ONE December 3, 2014. DOI: 10.1371/journal.pone.0113466
(14) Speckmann, E.-J., Hescheler, J. & Köhling, R. (2008): Physiologie. Urban & Fischer Verlag, München.
(15) European Respiratory Society (eds. 2017). European Lung White Book. Respiratory Health and Didease in Europe. Sheffield. Available at: http://www.erswhitebook.org/chapters/the-burden-of-lung-disease/ [Accessed 26 Sep. 2017].
(16) Merkblatt zu der Berufskrankheit Nr. 1315 der Anlage zur Berufskrankheiten-Verordnung (BKV) "Erkrankungen durch Isocyanate, die zur Unterlassung aller Tätigkeiten gezwungen haben, die für die Entstehung, die Verschlimmerung oder das Wiederaufleben der Krankheit ursächlich waren oder sein können". Bek. des BMGHS, BarbBl. 3/2004, S.32. https://www.baua.de/DE/Angebote/Rechtstexte-und-Technische-Regeln/Berufskrankheiten/pdf/Merkblatt-1315.pdf?__blob=publicationFile
(17) https://www.lenntech.de/pse/elemente/be.htm
(18) http://www.wma-sb.de/products/167/W15-Werkstoff-CuBe2_07.27.pdf
(19) Schütt, C. & Bröker, B. (2011): Grundwissen Immunologie. Spektrum Verlag, Heidelberg.
(20) http://flexikon.doccheck.com/de/Interleukin-13
(21) https://www.animaltestinfo.de/
(22) http://www.epithelix.com/
(23) Aline Chary, Jennifer Hennen, Sebastian G. Klein, Tommaso Serchi, Arno C. Gutleb & Brunhilde Blömeke (2017): Respiratory sensitization: toxicological point of view on the available assays. Arch Toxicol (2017). https://doi.org/10.1007/s00204-017-2088-5
(24) Klein, S. G., Serchi, T., Hoffmann, L., Blömeke, B. & Gutleb, A. C. (2013): An improved 3D tetraculture system mimicking the cellular organisation at the alveolar barrier to study the potential toxic effects of particles on the lung. Particle and Fibre Toxicology 10: 31. http://www.particleandfibretoxicology.com/content/10/1/31
(25) http://www.cultex-laboratories.com/
(26) Fitzpatrick, S. (2017): ‘Organs-on-Chips’ Technology: FDA Testing Groundbreaking Science. Posted on April 11, 2017 by FDA Voice. https://blogs.fda.gov/fdavoice/index.php/2017/04/organs-on-chips-technology-fda-testing-groundbreaking-science/
(28) Environment Directorate Joint Meeting of the Chemicals Committee and the Working Party on Chemicals, Pesticides and Biotechnology (2016): Guidance Document on Considerations for Waiving or Bridging of Mammalian Acute Toxicity Tests. Series on Testing & Assessment Nr. 237. ENV/JM/MONO(2016)32.
(30) Belinsky, S. A., Stefanski, S. A. & Anderson, M. W. (1993): The A/J Mouse Lung as a Model for Developing New Chemointervention Strategies. CANCER RESEARCH 53: 410-416.
(31) https://www.jax.org/strain/000646
(32) http://www.epithelix.com/products/oncocilair
(33) Mas, C., Benainous, H., Huang, S., Wiszniewski, L. & Constant, S. (2017): Oncogenic Transformation of a Functional 3D Human Airway Epithelium for In Vitro Lung Cancer Modelling. American Journal of Respiratory and Critical Care Medicine 195: A2370. http://www.atsjournals.org/doi/abs/10.1164/ajrccm-conference.2017.195.1_MeetingAbstracts.A2370
(34) Skardal, A., Murphy, S. V., Devarasetty, M., Mead, I. et al. (2017): Multi-tissue interactions in an integrated three-tissue organ-on-a-chip platform. Scientific Reports 7: 8837, DOI:10.1038/s41598-017-08879-x
(35) http://flexikon.doccheck.com/de/Alpha-1-Antitrypsin-Mangel
Glossar:
(a) a1-Antrypsin: ein Proteinaseinhibitor, der dazu beiträgt, dass ein wichtiges Enzym (Elastin) in den Lungenalveolen enzymatisch zersetzt wird. Die Folge ist ein Lungenemphysem (35, 36).
(b) systemisch: gemeint ist die arterielle Zirkulation, also in den Blutgefäßen.
(c) A/J-Maus: Inzuchtmaus, die weit verbreitet für Krebs- und Karzinogenitätsstudien verwendet wird. Sie entwickelt leicht Tumore.
(d) COPD: Chronisch-obstruktive Lungenerkrankung (chronic obstructive pulmonary disease), die mit Husten, Bronchitis und Atembeschwerden einhergeht.
